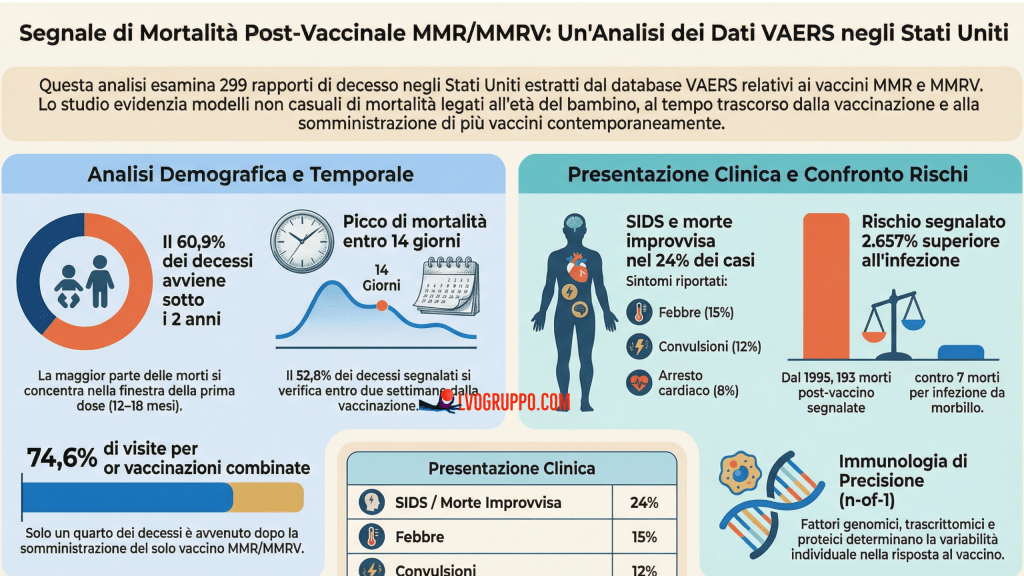
Un’indagine sui rapporti di sicurezza riservati rivela clustering di decessi post-vaccinazione e dati inspiegabilmente scomparsi
Il 23 ottobre 2000, l’Unione Europea autorizzò la commercializzazione di due vaccini esavalenti destinati a rivoluzionare il calendario vaccinale infantile: Infanrix hexa, prodotto da GlaxoSmithKline (GSK), e Hexavac, prodotto da Sanofi Pasteur MSD.
Questi vaccini combinavano in un’unica formulazione la protezione contro difterite, tetano, pertosse acellulare, epatite B, poliomielite inattivata e Haemophilus influenzae tipo B.
Per i genitori europei, rappresentavano una promessa di protezione completa con un numero ridotto di iniezioni.
Per le autorità sanitarie, un traguardo di efficienza logistica, per il mercato farmaceutico, un prodotto da milioni di dosi.
Nei mesi e negli anni successivi alla commercializzazione, tuttavia, emersero segnalazioni spontanee di morti improvvise e inaspettate nei giorni immediatamente successivi alla somministrazione di questi vaccini.
Nel 2005, un’analisi indipendente condotta dal professor Rüdiger von Kries e colleghi rivelò un dato allarmante: nei bambini vaccinati nel secondo anno di vita con Hexavac, il tasso di mortalità standardizzato (SMR) nei primi due giorni dopo la vaccinazione era significativamente aumentato.
Hexavac fu ritirato dal mercato su richiesta del titolare dell’autorizzazione all’immissione in commercio. Infanrix hexa rimase.
Ciò che i genitori europei non seppero mai — e che solo oggi emerge con chiarezza — è che i rapporti periodici di sicurezza confidenziali sottoposti da GSK all’Agenzia Europea dei Medicinali (EMA) contenevano evidenze di un pattern inquietante anche per Infanrix hexa: un addensamento anomalo di morti nei giorni immediatamente successivi alla vaccinazione, concentramento che non poteva essere spiegato con la semplice coincidenza statistica.
Ma non è solo questo a sollevare interrogativi gravi. L’analisi dettagliata di questi rapporti rivela che i dati stessi sembrano essere stati modificati nel corso del tempo, con decessi documentati in un rapporto che scompaiono misteriosamente nel successivo.
Questo articolo ricostruisce la vicenda attraverso lo studio indipendente pubblicato dal dottor Jacob Puliyel e dalla dottoressa C. Sathyamala, analizzando i Rapporti Periodici di Aggiornamento sulla Sicurezza (PSUR) 15, 16 e 19 di Infanrix hexa. Lo scopo non è alimentare allarmismi, ma illuminare zone d’ombra che troppo a lungo sono rimaste precluse al dibattito pubblico, e chiedere conto alle autorità regolatorie della diligenza esercitata nella valutazione della sicurezza di un prodotto somministrato a milioni di bambini.
Make a one-time donation
Make a monthly donation
Make a yearly donation
Scegli un importo
O inserisci un importo personalizzato
Your contribution is appreciated.
Your contribution is appreciated.
Your contribution is appreciated.
DonateDonate monthlyDonate yearly
1. I Rapporti Periodici di Aggiornamento sulla Sicurezza: Custodi Silenziosi o Documenti d’Archivio?
Prima di addentrarci nei dettagli dell’analisi, è fondamentale comprendere cosa siano i PSUR e quale ruolo dovrebbero svolgere nel sistema di farmacovigilanza. L’acronimo PSUR sta per Periodic Safety Update Report, ovvero Rapporto Periodico di Aggiornamento sulla Sicurezza. Si tratta di documenti che i produttori farmaceutici sono tenuti a sottoporre periodicamente alle autorità regolatorie dopo l’autorizzazione di un medicinale. Il loro scopo dichiarato è fornire una valutazione completa e critica del rapporto rischio-beneficio del farmaco, incorporando tutti i nuovi dati di sicurezza disponibili dall’ultimo rapporto.
La normativa europea, codificata nella Direttiva 2001/83/CE, stabilisce che l’EMA sia responsabile della protezione della salute pubblica attraverso la valutazione dei medicinali da essa autorizzati. I produttori, dal canto loro, sono responsabili dell’efficacia, della qualità e della sicurezza dei loro prodotti. I PSUR rappresentano lo strumento principale attraverso cui questa responsabilità viene monitorata nel tempo: dovrebbero fungere da meccanismo di allarme precoce, identificando segnali di sicurezza che richiedano attenzione o intervento.

Nella teoria, i PSUR dovrebbero contenere un’analisi rigorosa di tutti gli eventi avversi segnalati, confrontandoli con i tassi attesi nella popolazione generale. Se un farmaco causa più eventi avversi di quanto ci si aspetterebbe per semplice coincidenza, questo dovrebbe emergere chiaramente nel rapporto, innescando una valutazione da parte delle autorità regolatorie e potenzialmente portando a modifiche nelle indicazioni, nelle controindicazioni, o persino al ritiro del prodotto.
Nella pratica, tuttavia, i PSUR godono di uno status ambiguo: sono documenti confidenziali, accessibili solo alle autorità regolatorie e al produttore stesso. Il pubblico, i pazienti, i medici prescrittori e persino molti decisori politici non hanno modo di esaminarli direttamente. Questa segretezza è giustificata con la necessità di proteggere informazioni commerciali sensibili, ma solleva legittime domande sulla trasparenza del sistema di vigilanza post-marketing. Quando emergono criticità come quelle che esamineremo, la prima domanda che sorge è: queste informazioni erano disponibili alle autorità? Se sì, sono state valutate adeguatamente? Se no, perché?
I PSUR oggetto di questa analisi — i numeri 15, 16 e 19 — sono stati resi disponibili al pubblico attraverso percorsi giudiziari e richieste di accesso agli atti. Il tribunale italiano del giudice Nicola Di Leo ha ordinato la consegna dei PSUR 15 e 16, mentre il PSUR 19 è stato ottenuto dalla dottoressa Loretta Bolgan dall’EMA ai sensi dell’Articolo 3 delle regole EMA (EMA 110196/2006). Questa circostanza — la necessità di ricorrere a vie legali o a richieste formali per accedere a documenti che dovrebbero garantire la sicurezza dei pazienti — dice già molto sulla natura del sistema.
2. Il Caso Hexavac: Il Precedente Ignorato
La storia di Infanrix hexa non può essere compresa senza prima esaminare il caso del suo vaccino gemello, Hexavac. Entrambi i prodotti furono autorizzati contemporaneamente nell’ottobre 2000, entrambi combinavano le stesse sei antigeni, e entrambi suscitarono ben presto preoccupazioni per le segnalazioni di morti improvvise post-vaccinazione.
Nel 2005, il professor Rüdiger von Kries e un gruppo di ricercatori tedeschi pubblicarono un’analisi che avrebbe dovuto far tremare le fondamenta del sistema di farmacovigilanza europeo. Lo studio, intitolato “Sudden and unexpected deaths after the administration of hexavalent vaccines”, esaminò i decessi osservati dopo la vaccinazione confrontandoli con i decessi che ci si sarebbe aspettati per semplice coincidenza statistica. Il risultato fu inequivocabile: per Hexavac, il rapporto standardizzato di mortalità (SMR) nei primi due giorni dopo la vaccinazione era significativamente aumentato nei bambini vaccinati nel secondo anno di vita. Questo significa che il numero di morti osservato superava in modo statisticamente significativo il numero atteso per puro caso.
Il termine “rapporto standardizzato di mortalità” (SMR) richiede una spiegazione approfondita, poiché è centrale nella comprensione di tutta la vicenda. L’SMR è un indicatore utilizzato in epidemiologia per confrontare la mortalità osservata in un gruppo specifico con la mortalità attesa in quella stessa popolazione, calcolata applicando i tassi di mortalità della popolazione generale. Un SMR di 1,0 indica che la mortalità osservata corrisponde esattamente a quella attesa. Un SMR superiore a 1,0 indica un eccesso di mortalità; un SMR inferiore a 1,0 indica una riduzione. Perché un SMR sia considerato “significativamente aumentato”, tuttavia, deve superare non solo il valore 1,0 ma anche i limiti dell’intervallo di confidenza, tipicamente calcolato al 95%. Questo intervallo rappresenta l’intervallo entro cui il vero valore dell’SMR ha il 95% di probabilità di trovarsi; se l’intervallo non include il valore 1,0, possiamo dire con ragionevole certezza che l’aumento non è dovuto alla sola variabilità casuale.
I risultati di von Kries non lasciavano spazio a interpretazioni ambigue: per i bambini vaccinati con Hexavac nel secondo anno di vita, il rischio di morte nei primi due giorni dopo l’iniezione era significativamente più alto di quanto ci si aspetterebbe per caso. La risposta delle autorità fu il ritiro di Hexavac dal mercato europeo nel settembre 2005, su richiesta del titolare dell’autorizzazione all’immissione in commercio.
Ciò che accadde dopo Hexavac, tuttavia, solleva domande che ancora oggi attendono risposta. Infanrix hexa, prodotto da GSK, continuò a essere commercializzato. Le analisi di von Kries non avevano riscontrato un aumento significativo dell’SMR per Infanrix hexa nello stesso periodo. Ma questo risultato negativo doveva essere interpretato con cautela: lo studio aveva esaminato solo un numero limitato di decessi, e la potenza statistica per rilevare aumenti di rischio modesti era limitata. La questione rimaneva aperta, e avrebbe dovuto essere oggetto di vigilanza attiva nei rapporti di sicurezza successivi.

3. Il PSUR 15: Il Clustering delle Morti nei Primi Giorni
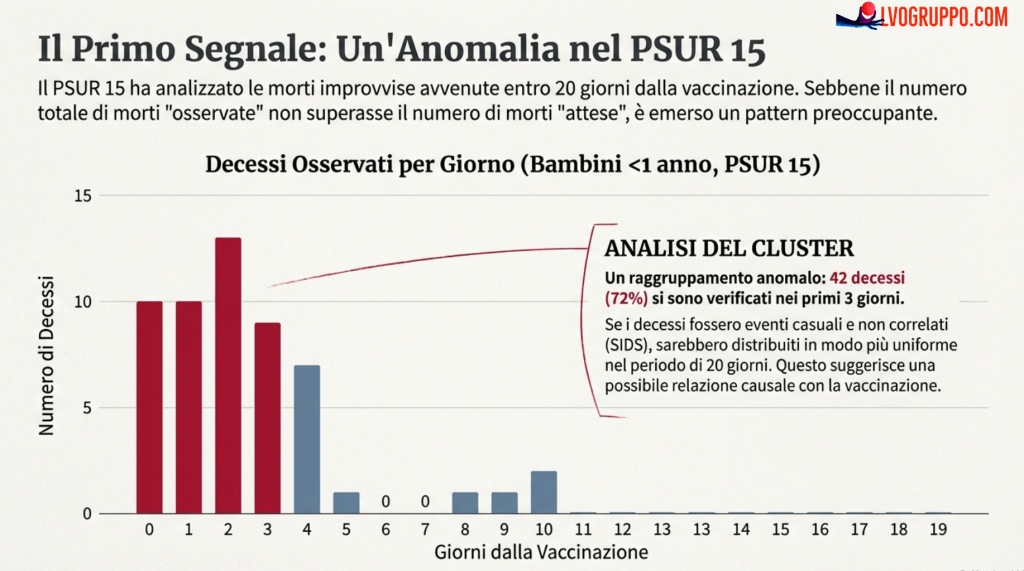
Il primo documento che esamineremo in dettaglio è il PSUR 15 di Infanrix hexa, che copre il periodo fino al 2009. Questo rapporto contiene un’analisi cruciale: il confronto tra i decessi improvvisi osservati dopo la vaccinazione e i decessi che ci si aspetterebbe per semplice coincidenza statistica. Per comprendere questa analisi, dobbiamo prima chiarire cosa si intenda per “morte improvvisa” e come venga definita nei documenti ufficiali.
Il PSUR 15 distingue tra due categorie diagnostiche. La prima è la sindrome della morte improvvisa infantile (SIDS, Sudden Infant Death Syndrome), definita come morte che si verifica nel primo anno di vita e rimane inspiegata dopo l’autopsia. La seconda è la morte improvvisa inspiegata (SUD, Sudden Unexpected Death), definita come morte che si verifica nei primi due anni di vita e rimane inspiegata dopo la valutazione clinica e la ricostruzione della storia degli eventi, ma senza autopsia. Insieme, queste due categorie vengono considerate come “morte improvisa” (SD, Sudden Death) nell’analisi.
La logica dell’analisi osservato/atteso è la seguente: in una popolazione di milioni di bambini vaccinati, è inevitabile che alcuni di essi muoiano per SIDS o SUD nei giorni successivi alla vaccinazione, anche se il vaccino non ha alcuna responsabilità. Questi eventi sarebbero accaduti comunque, indipendentemente dalla vaccinazione. La domanda chiave è: il numero di tali decessi supera quello che ci si aspetterebbe per pura coincidenza?
Per rispondere, il PSUR 15 stima il numero di decessi attesi utilizzando i tassi di mortalità per SIDS/SUD nella popolazione generale tedesca (poiché la Germania è il principale mercato per Infanrix hexa, con circa il 30% delle dosi distribuite). I tassi utilizzati sono 0,454 decessi per 1000 nati vivi nel primo anno di vita e 0,062 per 1000 nel secondo anno di vita (dati 2008). Questi tassi vengono poi applicati al numero stimato di dosi distribuite, distinto per anno di vita dei vaccinati.
Il PSUR 15 stima che il 90,6% delle dosi di Infanrix hexa sia stato somministrato a bambini nel primo anno di vita e il 9,4% a bambini nel secondo anno di vita. Basandosi su questa distribuzione e sui tassi di mortalità tedeschi, il rapporto calcola i decessi attesi per ciascun intervallo di tempo dopo la vaccinazione.

I risultati, come mostrato nella tabella seguente (adattata dalla Tabella 24 del PSUR 15), presentano un quadro che merita un’attenta analisi:
| Giorni dopo vaccinazione | Decessi osservati (1° anno) | Decessi cumulativi osservati | Decessi cumulativi attesi | Decessi osservati (2° anno) | Decessi cumulativi osservati | Decessi cumulativi attesi |
| <1 giorno | 10 | 10 | 54,7 | 1 | 1 | 0,8 |
| 1 giorno | 10 | 20 | 109,3 | 1 | 2 | 1,5 |
| 2 giorni | 13 | 33 | 164,0 | 1 | 3 | 2,3 |
| 3 giorni | 9 | 42 | 218,6 | 3 | 6 | 3,1 |
| 4 giorni | 7 | 49 | 273,3 | 3 | 9 | 3,9 |
| 5 giorni | 15 | 64 | 327,9 | 3 | 12 | 4,6 |
| 6 giorni | 0 | 64 | 382,6 | 0 | 12 | 5,4 |
| 7 giorni | 1 | 65 | 437,3 | 1 | 13 | 6,2 |
| 8 giorni | 1 | 66 | 491,9 | 1 | 14 | 7,0 |
| 9 giorni | 2 | 68 | 546,6 | 0 | 14 | 7,7 |
| 10-19 giorni | 5 | 73 | 1093,1 | 0 | 14 | 15,5 |
Guardando questa tabella, emerge un pattern che dovrebbe catturare l’attenzione di qualsiasi revisore attento.
Nel primo anno di vita, 42 decessi (il 93% del totale di 54) si concentrano nei primi 10 giorni dopo la vaccinazione, mentre solo 4 decessi (il 7%) si verificano nei 10 giorni successivi. Se le morti fossero state genuine SIDS — eventi casuali che sarebbero accaduti indipendentemente dalla vaccinazione — ci si aspetterebbe una distribuzione uniforme nell’arco dei 20 giorni. Il fatto che la stragrande maggioranza dei decessi si concentri nei primi giorni dopo l’immunizzazione suggerisce una relazione temporale che non può essere liquidata come semplice coincidenza.
Analogamente, nel secondo anno di vita, 5 decessi su 6 (l’83,3%) si verificano nei primi 10 giorni, con solo 1 decesso nei 10 giorni successivi. Questo pattern di “clustering” temporale è esattamente il tipo di segnale che dovrebbe attivare un’indagine approfondita.
Lo stesso pattern fu osservato anche nel PSUR 16, confermando che non si trattava di un’anomalia isolata ma di un fenomeno persistente nel tempo. Eppure, come vedremo, la risposta del produttore e delle autorità regolatorie fu tutt’altro che adeguata.
4. La Risposta di GSK: Ammissioni Velate e Assicurazioni Vuote
Di fronte alle evidenze di clustering dei decessi, la risposta di GlaxoSmithKline merita un’attenta analisi critica. Il Chief Medical Officer dell’azienda, dottor Norman Begg, rispose per conto del CEO Sir Andrew Witty con una lettera che, pur non negando i dati, proponeva una spiegazione alternativa: i giornalisti e i genitori che riportano gli eventi avversi sono molto più propensi a pensare a una possibile associazione causale e a segnalare un evento a GSK se questo si verifica poco dopo la vaccinazione piuttosto che se si verifica settimane dopo.
In altre parole, GSK sosteneva che il clustering osservato non era reale ma artefattuale: non c’era un vero aumento di morti nei primi giorni dopo la vaccinazione, semplicemente le morti che si verificavano in quel periodo venivano segnalate più frequentemente perché i genitori e i medici facevano l’associazione temporale. Se una morte per SIDS fosse avvenuta tre settimane dopo la vaccinazione, nessuno ci avrebbe pensato e nessuno l’avrebbe segnalata.
Questa spiegazione, per quanto plausibile in linea di principio, solleva diverse obiezioni critiche. La prima riguarda la natura stessa della sorveglianza post-marketing. GSK ammette implicitamente che non esisteva un sistema di sorveglianza attiva nel periodo post-vaccinazione: i decessi venivano inclusi solo se segnalati spontaneamente. Questo significa che il numero di “decessi osservati” riportato nei PSUR è inevitabilmente una sottostima del numero reale di decessi verificatisi dopo la vaccinazione. Se il sistema di raccolta dati è difettoso, come possono i risultati dell’analisi essere considerati affidabili?
La seconda obiezione riguarda la stima dei “decessi attesi”. Per calcolare il rapporto osservato/atteso, GSK utilizza il numero di dosi di vaccino distribuite, non il numero di dosi effettivamente somministrate. Il rapporto stesso riconosce che non tutte le dosi distribuite vengono necessariamente utilizzate: alcune potrebbero essere andate oltre la data di scadenza, altre potrebbero essere state conservate impropriamente, altre ancora potrebbero non essere mai state somministrate per vari motivi. Se il numero di dosi distribuite è maggiore del numero di dosi effettivamente somministrate, il numero di “decessi attesi” viene sovrastimato. Una sovrastima dei decessi attesi produce artificialmente un rapporto osservato/atteso più basso, mascherando potenziali segnali di sicurezza.
La terza obiezione, forse la più significativa, riguarda il silenzio sulla questione fondamentale: se il clustering temporale è reale — e i dati del PSUR 15 mostrano un pattern inequivocabile — perché non avviare un’indagine per determinarne la causa? La lettera di GSK si conclude con l’assicurazione che l’azienda “rimane impegnata a notificare prontamente le autorità e a prendere le azioni necessarie per comunicare tali dati ai professionisti sanitari” qualora i dati suggerissero un aumento del rischio. Ma i dati erano già lì, nero su bianco, nel PSUR 15: il clustering temporale era evidente. La questione non era se i dati “suggerissero” un aumento del rischio, ma se le autorità regolatorie stessero effettivamente esaminando quei dati con la dovuta diligenza.
Non sorprende che, alla luce di questa risposta e delle assicurazioni fornite, la questione del clustering dei decessi non fu perseguita oltre. La vicenda, tuttavia, era tutt’altro che conclusa.
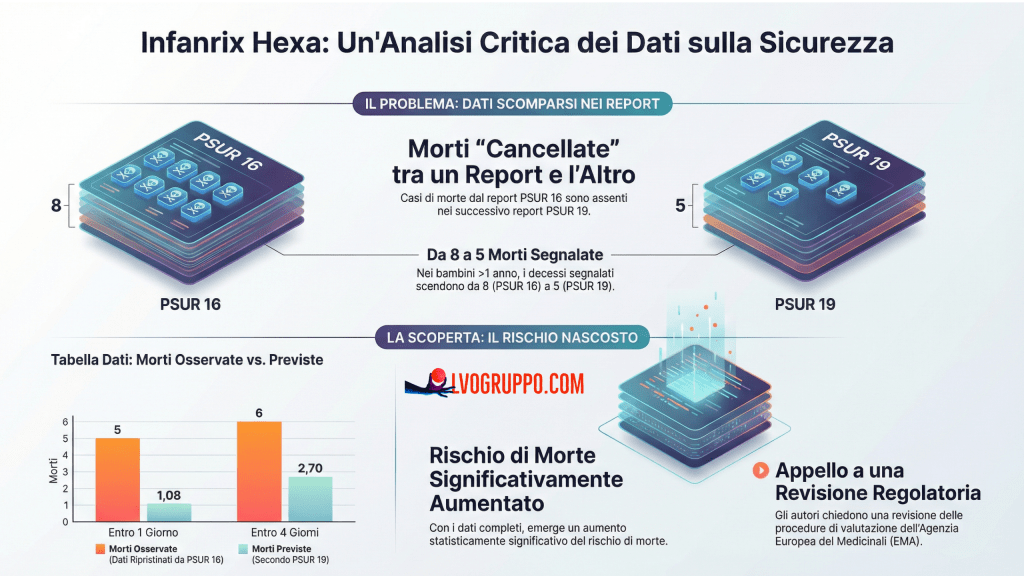
5. Il Mistero delle Morti Scomparse: PSUR 16 vs PSUR 19
Il cuore dell’analisi di Puliyel e Sathyamala risiede nel confronto tra i dati riportati nel PSUR 16 e quelli successivamente inclusi nel PSUR 19. Questo confronto solleva interrogativi che vanno oltre la semplice interpretazione dei dati e toccano la credibilità stessa del sistema di farmacovigilanza.
Il PSUR 16 copre il periodo fino al 2011 e include dati su 69 milioni di dosi distribuite. Il PSUR 19 copre il periodo fino al 22 ottobre 2014 e include dati su 112 milioni di dosi distribuite. Logica vorrebbe che, essendo aumentato il numero totale di dosi, il numero di eventi avversi — inclusi i decessi — dovesse essere proporzionalmente maggiore nel rapporto più recente.
Eppure, i dati raccontano una storia diversa. Il PSUR 19 riporta complessivamente meno decessi del PSUR 16 per alcuni periodi temporali, nonostante la base di esposizione sia significativamente più ampia. Particolarmente significativo è il confronto sui decessi nel secondo anno di vita: il PSUR 16 riporta 8 decessi nei primi 19 giorni dopo la vaccinazione nei bambini sopra l’anno di età, mentre il PSUR 19 ne riporta solo 5.

Come è possibile che decessi documentati in un rapporto precedente scomparsa nel successivo? Gli autori suggeriscono diverse spiegazioni possibili, nessuna delle quali è completamente soddisfacente. La prima ipotesi è che alcune segnalazioni siano state ritirate o invalidate nel periodo intercorso tra i due rapporti. Questo potrebbe accadere se, ad esempio, ulteriori informazioni avessero rivelato che il decesso non era effettivamente avvenuto dopo la vaccinazione con Infanrix hexa, o se i dati fossero stati duplicati inizialmente e poi deduplicati. Tuttavia, non c’è evidenza nei documenti che spieghi perché 3 decessi siano stati rimossi.
La seconda ipotesi, più inquietante, è che i criteri di inclusione siano stati modificati tra i due rapporti. Il PSUR 19 esclude esplicitamente i casi in cui l’età del bambino al momento della vaccinazione non era nota, il tempo intercorso tra vaccinazione e morte non era registrato, o il tempo superava i 19 giorni. Se queste esclusioni fossero state applicate retroattivamente ai dati del PSUR 16, potrebbero spiegare alcune delle differenze. Ma non spiegano tutto: il PSUR 16, a sua volta, documentava l’età e il tempo intercorso per ciascun decesso.
La terza ipotesi, che gli autori sollevano con cautela ma con crescente preoccupazione, è che i dati siano stati in qualche modo modificati o selezionati per produrre un quadro più favorevole. Gli autori citano un precedente significativo: nel 2014, William Thompson, ricercatore presso i Centers for Disease Control and Prevention (CDC) americano, ammise che lui e i suoi coautori avevano omesso informazioni statisticamente significative in un articolo sul rapporto tra vaccino MPR (morbillo, parotite, rosolia) e autismo. In quel caso, i dati erano stati letteralmente eliminati dall’analisi per presentare conclusioni diverse. Non è irragionevole chiedersi se dinamiche simili possano essere avvenute nei rapporti GSK.
Qualunque sia la spiegazione, il risultato è che quando i decessi riportati nel PSUR 16 vengono reintegrati nell’analisi del PSUR 19, il quadro cambia drasticamente. Utilizzando i dati originali del PSUR 16 (che riportano più decessi), il numero di decessi osservati nel secondo anno di vita nei primi quattro giorni dopo la vaccinazione risulta significativamente superiore ai decessi attesi, con un intervallo di confidenza Poisson del 95% che non include il valore zero. In altre parole, l’apparente assenza di rischio nel PSUR 19 potrebbe essere un artefatto di dati rimossi, non una rappresentazione accurata della realtà.

6. L’Analisi Statistica Accessibile: Comprendere i Dati
Per valutare adeguatamente le implicazioni dei dati sui PSUR, è necessario comprendere alcuni concetti statistici fondamentali che gli autori utilizzano nelle loro analisi. Questi concetti non sono complicati, ma la loro comprensione è essenziale per interpretare correttamente i risultati.
Il primo concetto è la distribuzione di Poisson. Quando si contano eventi rari che si verificano indipendentemente l’uno dall’altro — come i decessi in una grande popolazione — la distribuzione di Poisson fornisce un modello matematico accurato. Questa distribuzione ha una proprietà importante: la varianza è uguale alla media. Se ci si aspetta di osservare un certo numero medio di eventi (λ), la distribuzione di Poisson ci dice quanto è probabile osservare 0 eventi, 1 evento, 2 eventi, e così via.
Il secondo concetto è l’intervallo di confidenza Poisson. Dato un numero osservato di eventi, l’intervallo di confidenza al 95% rappresenta l’intervallo di valori entro cui il vero tasso di evento ha il 95% di probabilità di trovarsi. Se, ad esempio, osserviamo 3 decessi in un periodo in cui ce ne aspettavamo 1, l’intervallo di confidenza Poisson ci dice quanto sia plausibile che il vero tasso di mortalità sia effettivamente più alto del previsto. Se l’intervallo di confidenza non include il valore “decessi attesi”, possiamo concludere che l’aumento osservato è statisticamente significativo — molto improbabile che sia dovuto al solo caso.
Nel PSUR 19, l’intervallo di confidenza Poisson al 95% per i decessi osservati nel secondo anno di vita viene riportato nella Tabella 8 a pagina 447. Secondo questo rapporto, per il secondo anno di vita, il numero di decessi osservati era superiore, sebbene non in modo significativo, ai decessi attesi in un periodo di rischio di 1-4 giorni dopo la vaccinazione. “Non significativo” significa che l’intervallo di confidenza includeva ancora il valore dei decessi attesi, quindi non potevamo escludere che l’aumento fosse dovuto al caso.
Ma questa conclusione si basa sui dati del PSUR 19, che includono meno decessi del PSUR 16. Quando Puliyel e Sathyamala reintegrano i decessi del PSUR 16 nell’analisi, i risultati cambiano. Utilizzando i dati originali (più decessi), l’intervallo di confidenza Poisson al 95% per i decessi cumulativi nei primi quattro giorni dopo la vaccinazione diventa (2,20 – 13,05). Poiché l’intervallo non include il valore dei decessi attesi calcolati, possiamo concludere che l’aumento è statisticamente significativo.
È importante sottolineare che i decessi “osservati” raccolti passivamente (attraverso segnalazioni spontanee) sono probabilmente una sottostima dei decessi reali: non tutti i decessi vengono segnalati, soprattutto se il nesso temporale con la vaccinazione non è immediatamente evidente. D’altra parte, i decessi “attesi” calcolati utilizzando le dosi distribuite (invece delle dosi effettivamente somministrate) sono probabilmente una sovrastima: se alcune dosi non vengono utilizzate, il numero di bambini effettivamente vaccinati è inferiore a quello ipotizzato. Una sovrastima dei decessi attesi maschera potenziali aumenti del rischio. Se anche con questa sovrastima l’aumento risulta significativo, il segnale di sicurezza è particolarmente robusto.

7. Il Problema Metodologico delle Dosi nel Secondo Anno di Vita
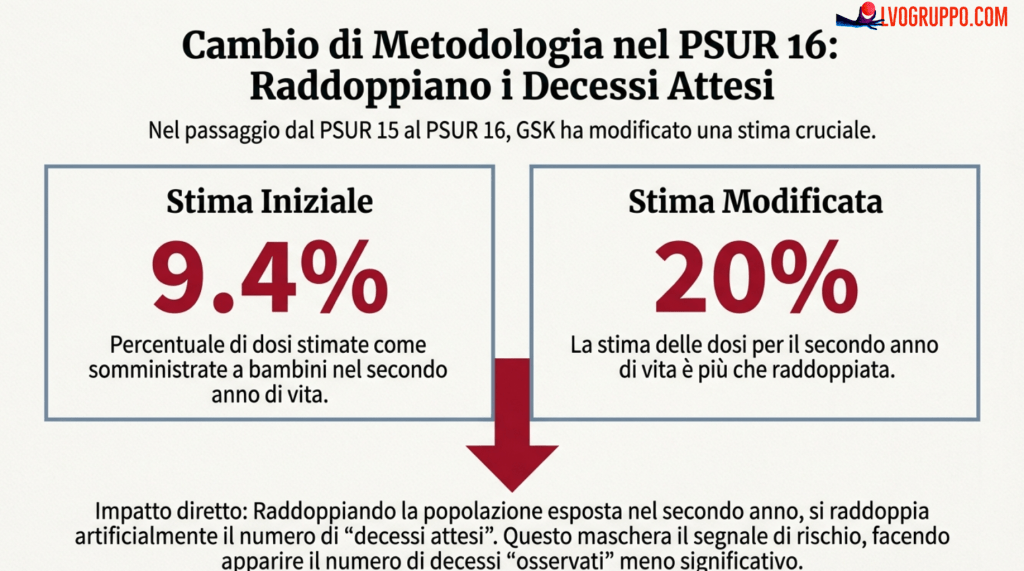
Uno degli aspetti più tecnici ma cruciali dell’analisi riguarda la stima della proporzione di dosi utilizzate nel secondo anno di vita dei bambini. Questa stima è fondamentale per calcolare i decessi attesi: se la proporzione è sbagliata, lo sono anche tutti i calcoli che ne derivano.
Nel PSUR 15, si stima che il 9,4% delle dosi sia stato utilizzato per bambini sopra l’anno di età e il 90,6% per bambini sotto l’anno. Questa stima sembra ragionevole: in Germania, dove si concentra circa il 30% delle dosi, il calendario vaccinale prevede quattro dosi di vaccino esavalente, con l’ultima dose somministrata nel secondo anno di vita. In Italia, tuttavia, il calendario prevede solo tre dosi, tutte nel primo anno. In altri paesi le schedule variano ulteriormente. Una media ponderata del 9,4% per il secondo anno appare plausibile.
Nel PSUR 16, tuttavia, la stima cambia drammaticamente: la percentuale di dosi utilizzate nel secondo anno passa dal 9,4% al 20%. Questo raddoppio ha conseguenze significative sui calcoli dei decessi attesi: se raddoppia il numero di dosi somministrate nel secondo anno, raddoppia anche il numero di decessi attesi in quel periodo. E se raddoppiano i decessi attesi, il rapporto osservato/atteso diminuisce, rendendo meno evidente qualsiasi potenziale aumento del rischio.
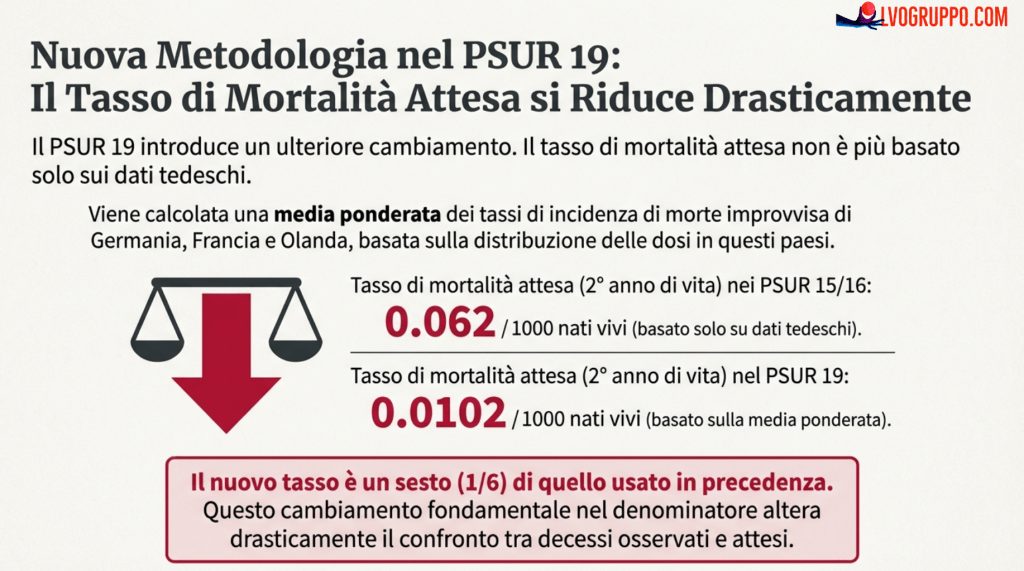
Ma su cosa si basa questo raddoppio? Il PSUR 19 usa un approccio ancora diverso: calcola una media ponderata dei tassi di mortalità per morte improvvisa in Germania, Francia e Olanda, dove le dosi sono distribuite. Se il 60% delle dosi sono distribuite in Germania in un dato anno, il tasso di mortalità tedesco riceve un peso del 60%; se il 30% in Francia, il peso è del 30%, e così via. Il tasso complessivo risultante per il secondo anno di vita è 0,0102 per 1000 nati vivi — un sesto del valore usato nei PSUR 15 e 16 (0,062 per 1000), che si basavano esclusivamente sui dati tedeschi.
Il problema metodologico più grave, tuttavia, è un altro. Il PSUR 19 assume che il 20,2% delle dosi sia stato utilizzato nel secondo anno di vita — e giustifica questa assunzione affermando che il 20,2% degli eventi avversi (inclusi i decessi) si è verificato in bambini sopra l’anno di età. In altre parole, deduce la distribuzione delle dosi dalla distribuzione degli eventi avversi osservati.

Questo approccio è logicamente circolare. Se si assume che tutti i decessi siano coincidenze casuali (non causati dal vaccino), e si osserva che il 20,2% dei decessi si verifica nel secondo anno, si può effettivamente dedurre che il 20,2% delle vaccinazioni avviene nel secondo anno. Ma questa deduzione funziona solo se l’assunzione di base è corretta — cioè se i decessi sono genuinamente casuali e non causati dal vaccino. Se, invece, il vaccino aumenta il rischio di morte nel secondo anno, allora la proporzione di decessi in quel periodo sarà maggiore della proporzione di vaccinazioni, e il calcolo sarà distorto.
Per capire l’assurdità della situazione, consideriamo questo ragionamento. Secondo il PSUR 19, il tasso naturale di morte improvvisa nel primo anno è 44 volte più alto che nel secondo anno (0,441 vs 0,0102 per 1000). Se l’80% dei decessi osservati avviene nel primo anno e il 20% nel secondo, per avere la stessa proporzione di decessi dovremmo vaccinare 44 volte piùcoli bambini nel secondo anno. Questo significherebbe assumere che il 91% delle dosi sia utilizzato nel secondo anno e solo il 9% nel primo — esattamente l’opposto di quanto avviene nella realtà. L’assurdità di questo risultato illustra perché il metodo di calcolo del PSUR 19 è metodologicamente insostenibile.
La conclusione degli autori è che una stima ragionevole della percentuale di dosi utilizzate nel secondo anno è probabilmente vicina al 9,4% del PSUR 15 — derivata dall’esame dei calendari vaccinali nei diversi paesi europei, non dalla circolarità degli eventi avversi osservati.

8. Il Dilemma Etico: La Metafora del Tram
L’analisi dei dati sui PSUR non può prescindere da una riflessione etica di più ampio respiro. Gli autori Puliyel e Sathyamala introducono una delle più celebri thought experiments della filosofia morale: il “dilemma del tram” (trolley problem), originariamente proposto dalla filosofa Philippa Foot.
Il dilemma classico è questo: un tram fuori controllo sta per uccidere cinque persone sulla sua traiettoria. Tu sei vicino a uno scambio che può deviare il tram su un binario laterale dove si trova solo una persona. Hai il dovere morale di azionare lo scambio? La maggior parte delle persone risponde di sì: salvare cinque vite al costo di una sembra un bilanciamento accettabile.
Una variazione più inquietante, proposta da Judith Thomson, complica il dilemma: potresti salvare cinque persone eliminandole e utilizzando i loro organi per trapianti? La risposta della maggior parte è no. Perché? Perché c’è una differenza morale tra deviare un processo letale già in corso (il tram) e attivamente uccidere qualcuno (il donatore) per raggiungere lo stesso risultato numerico.
Qual è la rilevanza di questo dilemma per i vaccini? Gli autori lo utilizzano per articolare un principio fondamentale: il fine non giustifica i mezzi. Se i dati mostrano un aumento del rischio di morte nei giorni successivi alla vaccinazione, questo rischio deve essere riconosciuto, comunicato e investigato — non minimizzato o ignorato per paura di minare la fiducia nei vaccini o di rallentare i programmi di immunizzazione.
Il ragionamento è il seguente: se si “glossa sopra” (si minimizza, si ignora, si nasconde) l’evidenza di un aumento del rischio, si può effettivamente prevenire o ritardare la valutazione rigorosa del profilo di sicurezza del vaccino. Questo ha il potenziale di risultare in più morti inutili — bambini che avrebbero potuto essere protetti da un prodotto più sicuro, o quantomeno informati del rischio esistente. Dal punto di vista etico, è difficile giustificare la scelta di sacrificare alcuni bambini (con la loro morte potenzialmente evitabile) per il bene maggiore della salute pubblica, senza almeno rendere trasparente questo trade-off e dare ai genitori la possibilità di fare una scelta informata.
Questo non significa che i vaccini siano “cattivi” o che i loro benefici non superino i rischi. Significa che il processo decisionale deve essere onesto, trasparente e rispettoso dell’autonomia dei genitori e dei pazienti. Se esistono dati che suggeriscono un aumento del rischio — anche se non definitivamente probante — questi dati devono essere comunicati, discussi e investigati, non sepolti in rapporti confidenziali che pochi hanno la possibilità di esaminare.
9. Le Domande Aperte e le Richieste di Trasparenza
L’analisi di Puliyel e Sathyamala solleva domande che, a distanza di anni dalla pubblicazione dello studio, attendono ancora risposte soddisfacenti. Queste domande non sono speculative: sono fondate su evidenze documentate nei rapporti ufficiali e meritano una risposta chiara da parte delle autorità regolatorie e del produttore.
La prima domanda riguarda le morti “scomparse”. Perché i decessi documentati nel PSUR 16 non compaiono nel PSUR 19? Qual è la spiegazione ufficiale per questa discrepanza? Se alcune segnalazioni sono state ritirate o invalidate, su quali basi? Se i criteri di inclusione sono cambiati, perché questo cambiamento non è stato documentato e giustificato nel rapporto?
La seconda domanda riguarda la metodologia di calcolo dei decessi attesi. Perché GSK ha cambiato la stima della percentuale di dosi utilizzate nel secondo anno di vita dal 9,4% al 20%, e poi ha utilizzato un metodo metodologicamente insostenibile (dedurre la distribuzione delle dosi dalla distribuzione degli eventi avversi)? Le autorità regolatorie hanno esaminato criticamente questi cambiamenti metodologici?
La terza domanda riguarda la comunicazione del rischio. Se i dati mostrano un aumento statisticamente significativo del rischio di morte nei primi giorni dopo la vaccinazione (una volta reintegrati i decessi del PSUR 16), perché questo rischio non è stato comunicato alle autorità regolatorie e ai professionisti sanitari che somministrano il vaccino? L’assicurazione del CEO di GSK, Sir Andrew Witty, di essere “impegnati a notificare prontamente le autorità” in caso di dati che suggeriscano un aumento del rischio, è stata onorata?
La quarta domanda riguarda la supervisione dell’EMA. Come ha potuto l’EMA accettare il PSUR 19 “così com’è”, senza notare le discrepanze con il PSUR 16 o richiedere chiarimenti sulla metodologia di calcolo? È stata esercitata la dovuta diligenza nella valutazione delle affermazioni del produttore? Se sì, come si concilia questa valutazione con le evidenze presentate nell’analisi indipendente?
Oltre a queste domande specifiche, c’è una richiesta più ampia di trasparenza. I PSUR sono documenti che dovrebbero servire l’interesse pubblico — la sicurezza dei pazienti. Eppure rimangono confidenziali, inaccessibili al pubblico e alla maggior parte dei professionisti sanitari. Il fatto che siano stati ottenuti solo attraverso vie legali e richieste formali solleva interrogativi sulla cultura di trasparenza del sistema di farmacovigilanza europeo. Perché i cittadini europei non hanno il diritto di sapere quali evidenze di sicurezza esistono sui prodotti che vengono somministrati ai loro figli?

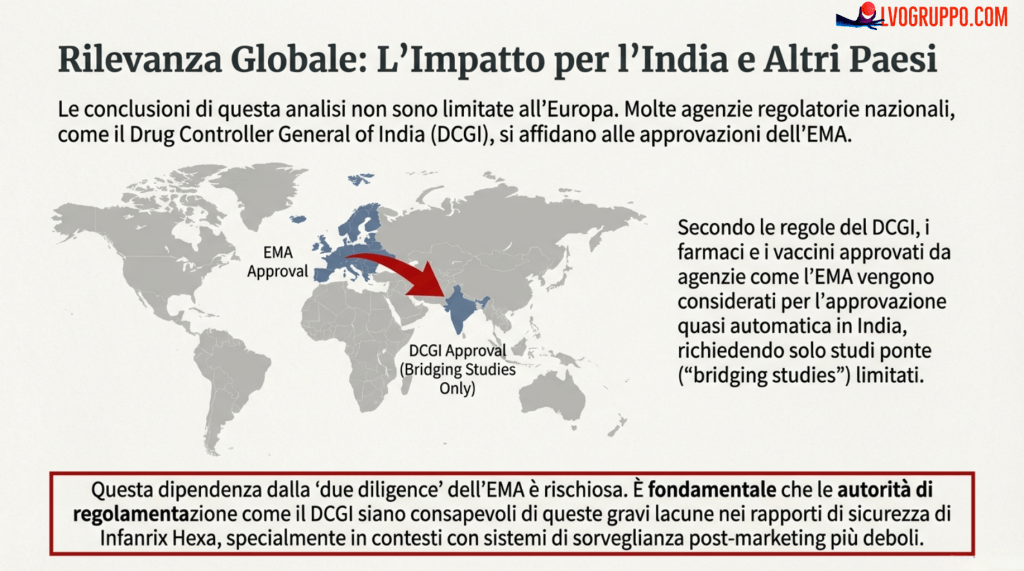
10. Rilevanza per l’India e i Paesi a Risorse Limitate
Lo studio di Puliyel e Sathyamala non è rilevante solo per l’Europa. Gli autori sottolineano esplicitamente le implicazioni per l’India, dove il Controller Generale dei Farmaci (DCGI) — l’autorità regolatoria indiana — ha una prassi di accettazione semi-automatica dei farmaci e vaccini già approvati dalle agenzie regolatorie di USA, UK, Canada, Giappone, Australia e Unione Europea. Sono richiesti solo studi di bridging per valutare l’impatto dei fattori etnici su efficacia, sicurezza, dosaggio e regimi posologici.
Recentemente, sono stati pubblicati studi indiani che esaminano l’immunogenicità e la sicurezza del vaccino esavalente combinato in trial su piccoli gruppi. Inoltre, la rivista Indian Pediatrics ha pubblicato un editoriale intitolato “Hexavalent vaccinations: The future of routine immunization?” che suggerisce la promozione di questo vaccino combinato in India.
La preoccupazione degli autori è legittima. I sistemi di sorveglianza in India sono più deboli di quelli europei: la segnalazione spontanea di eventi avversi è meno sistematica, il follow-up dei casi è più difficile, le risorse per la farmacovigilanza attiva sono limitate. Se anche in Europa — con un sistema di sorveglianza relativamente robusto — emergono questioni irrisolte sulla sicurezza di Infanrix hexa, cosa accadrà quando il vaccino sarà introdotto in paesi con sorveglianza meno efficace?
L’argomento non è che l’India non debba usare vaccini esavalenti — anzi, la combinazione di antigeni può semplificare i programmi di immunizzazione e aumentare la copertura. L’argomento è che le decisioni devono essere informate da tutte le evidenze disponibili, incluse quelle problematiche. Se le autorità regolatorie indiane si fidano ciecamente delle valutazioni dell’EMA senza esaminare criticamente le evidenze sottostanti, i pazienti indiani potrebbero essere esposti a rischi che non sarebbero accettabili in altri contesti.
11. Conclusioni: Verso una farmacovigilanza trasparente e responsabile
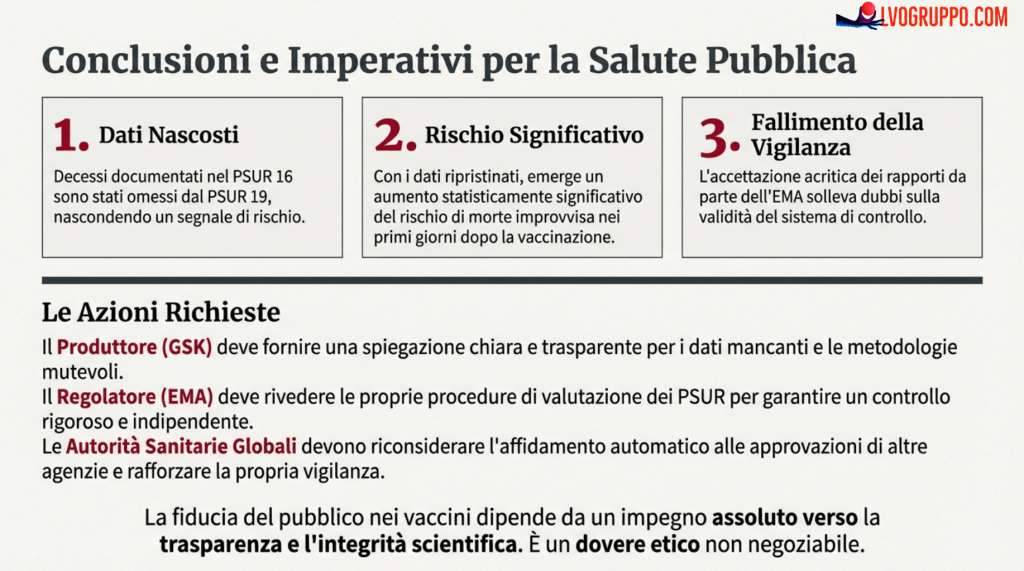
L’analisi dei Periodic Safety Update Reports di Infanrix hexa condotta da Jacob Puliyel e C. Sathyamala solleva questioni che vanno oltre questo specifico prodotto. Questioni che toccano le fondamenta stesse del sistema di farmacovigilanza europeo e la sua capacità di proteggere i pazienti.
I fatti documentati sono i seguenti: nei rapporti di sicurezza sottoposti da GSK all’EMA, emerge un clustering temporale di morti improvvise nei giorni immediatamente successivi alla vaccinazione — un pattern incompatibile con la semplice coincidenza. Quando i decessi documentati nel PSUR 16 vengono reintegrati nell’analisi del PSUR 19, il numero di decessi osservati risulta significativamente superiore ai decessi attesi nei primi quattro giorni dopo la vaccinazione nel secondo anno di vita. Eppure, l’EMA ha accettato il PSUR 19 senza apparentemente notare queste discrepanze, e il rischio aumentato non è stato comunicato ai professionisti sanitari.
Il tono di questo articolo non è allarmista. Non stiamo affermando che Infanrix hexa causi morti infantili. Stiamo affermando che esistono evidenze che non possono essere ignorate, domande che non hanno ricevuto risposte adeguate, e procedure che non sembrano aver funzionato come avrebbero dovuto. La differenza è sostanziale: chiedere trasparenza e accountability non significa rifiutare i vaccini, significa pretendere che la vigilanza sulla loro sicurezza sia all’altezza della responsabilità che porta.
I vaccini hanno salvato innumerevoli vite e continuano a farlo. La fiducia del pubblico nei programmi di immunizzazione è un bene prezioso che deve essere tutelato. Ma questa fiducia si costruisce sulla trasparenza, non sulla segretezza; sull’onestà, non sulla minimizzazione; sulla responsabilità, non sulla copertura. Quando le evidenze di potenziali rischi vengono sepolte in rapporti confidenziali, quando le discrepanze nei dati non vengono spiegate, quando le domande rimangono senza risposta, questa fiducia viene erosa — non dagli scettici, ma da coloro che avevano il compito di proteggerla.
Le raccomandazioni che emergono da questa analisi sono chiare. GSK deve spiegare le discrepanze tra i dati riportati nei diversi PSUR e fornire una giustificazione metodologica per i cambiamenti nei calcoli dei decessi attesi. L’EMA deve rivedere le procedure di valutazione delle affermazioni nei PSUR e spiegare come sia stato possibile accettare il PSUR 19 senza notare le anomalie documentate. Il DCGI dell’India e le autorità regolatorie di altri paesi che si affidano alle valutazioni dell’EMA devono essere informati delle criticità emerse e riconsiderare la prassi di accettazione automatica. I PSUR devono diventare documenti accessibili al pubblico, o quantomeno ai professionisti sanitari che hanno il compito di informare i pazienti.
Fino a quando queste condizioni non saranno soddisfatte, la vicenda di Infanrix hexa rimarrà una macchia sulla reputazione del sistema di farmacovigilanza europeo — un promemoria che la protezione della salute pubblica richiede vigilanza costante, non solo da parte delle autorità regolatorie, ma da parte di tutti: genitori, professionisti sanitari, giornalisti, cittadini.
Riferimenti Bibliografici
[1] von Kries R et al. – Sudden and unexpected deaths after hexavalent vaccines (Eur J Pediatr 2005) – Alta affidabilità – Pubblicazione peer-reviewed su rivista scientifica
[2] European Medicines Agency – Press Release: EMEA recommends suspension of Hexavac (2005) – Alta affidabilità – Comunicato stampa ufficiale dell’agenzia regolatoria europea
[3] Directive 2001/83/EC – Community code relating to medicinal products for human use – Alta affidabilità – Legislazione europea
[4] GSK Biological clinical safety and pharmacovigilance’s confidential report to the EMA: PSUR 15 and PSUR 16 – Alta affidabilità – Documento originale ottenuto tramite procedura giudiziaria
[5] GSK Biological clinical safety and pharmacovigilance’s confidential report to the EMA: PSUR 19 – Alta affidabilità – Documento originale ottenuto dall’EMA
[6] Puliyel J. – PubMed Commons comment on combined hexavalent vaccine experience in Italy – Media affidabilità – Commento del primo autore
[7] Sir Andrew Witty, CEO GSK, response through Norman Begg, Chief Medical Officer – Alta affidabilità – Documento originale del produttore
[8] De Stefano F et al. – Age at first measles-mumps-rubella vaccination in children with autism (Pediatrics 2004) – Alta affidabilità – Pubblicazione peer-reviewed
[9] Statement of William W Thompson, PhD, regarding MMR and autism article (2014) – Media affidabilità – Dichiarazione diretta del ricercatore
[10] CDC Statement Regarding 2004 Pediatrics Article on MMR and autism – Alta affidabilità – Posizione ufficiale del CDC
[11] Foot PR. The problem of abortion and the doctrine of the double effect (1978) – Alta affidabilità – Opera filosofica fondamentale
[12] Thomson JJ. The trolley problem (Yale Law Journal 1985) – Alta affidabilità – Pubblicazione accademica su rivista giuridica
[13] Central Drugs Standard Control Organisation – Guidelines on approval of clinical trial and new drugs (India) – Alta affidabilità – Linee guida ufficiali dell’autorità regolatoria indiana
[14] Liu JP, Chow SC. Bridging studies in clinical development (J Biopharm Stat 2002) – Alta affidabilità – Pubblicazione peer-reviewed su metodologia clinica
[15] Chhatwal J et al. – Immunogenicity and safety of liquid hexavalent vaccine in Indian infants (Indian Pediatr 2017) – Alta affidabilità – Pubblicazione peer-reviewed
[16] Lalwani SK et al. – Immunogenicity and safety of 3-dose primary vaccination with DTPa-HBV-IPV/Hib (Hum Vaccin Immunother 2017) – Alta affidabilità – Pubblicazione peer-reviewed
[17] Shashidhar A. Hexavalent vaccinations: The future of routine immunization? (Indian Pediatr 2017) – Alta affidabilità – Editoriale su rivista peer-reviewed
Avvertenza: Questo articolo ha finalità esclusivamente informative e divulgative. Non costituisce consulenza medica. Per qualsiasi decisione relativa alla vaccinazione dei propri figli, i genitori devono consultare il proprio pediatra o medico di fiducia.
Make a one-time donation
Make a monthly donation
Make a yearly donation
Scegli un importo
O inserisci un importo personalizzato
Your contribution is appreciated.
Your contribution is appreciated.
Your contribution is appreciated.
DonateDonate monthlyDonate yearlySCARICA LE SLIDE COMPLETE IN PDF
SCARICA LO STUDIO IN INGLESE
TRADUZIONE ITALIANO DELL STUDIO

Lasciate il vostro commento