Astratto
Importanza Il monitoraggio attivo degli esiti sanitari dopo la vaccinazione contro il COVID-19 fornisce il rilevamento precoce di esiti rari che potrebbero non essere identificati negli studi pre-autorizzazione.
Obiettivo Condurre un monitoraggio quasi in tempo reale degli esiti sanitari successivi alla vaccinazione COVID-19 nella popolazione pediatrica degli Stati Uniti (USA) di età compresa tra 6 mesi e 17 anni.
Progettazione Abbiamo valutato 21 risultati sanitari predefiniti; 15 sono stati testati in sequenza attraverso una sorveglianza quasi in tempo reale e 6 sono stati monitorati in modo descrittivo all’interno di una coorte di bambini vaccinati. Abbiamo testato l’aumento del tasso di ciascun risultato dopo la vaccinazione rispetto a una coorte storica di confronto.
Questo studio basato sulla popolazione è stato condotto nell’ambito del mandato di sorveglianza sanitaria pubblica della Food and Drug Administration statunitense, utilizzando tre database di dichiarazioni commerciali .
Partecipanti I bambini di età compresa tra 6 mesi e 17 anni sono stati inclusi se avevano ricevuto una dose di vaccino monovalente contro il COVID-19 prima dell’inizio del 2023 e avevano un’iscrizione continua a un piano di assicurazione sanitaria dall’inizio di una finestra pulita specifica per l’esito fino alla dose di vaccinazione contro il COVID-19. .
Esposizione L’ esposizione è stata definita come la ricezione di una dose di vaccino monovalente BNT162b2, mRNA-1273 o NVX-CoV2373 COVID-19. L’analisi primaria ha valutato la dose 1 e la dose 2 combinate, mentre le analisi secondarie hanno valutato ciascuna dose separatamente. Il tempo di follow-up è stato censurato in caso di decesso, annullamento dell’arruolamento, fine della finestra di rischio, fine del periodo di studio o successiva somministrazione della dose.
Risultati principali Ventuno risultati sanitari prespecificati.
Risultati Lo studio ha incluso 4.102.016 iscritti di età compresa tra 6 mesi e 17 anni. Tredici dei 15 risultati testati sequenzialmente non hanno raggiunto la soglia per un segnale statistico. Nell’analisi primaria, segnali di miocardite o pericardite sono stati rilevati dopo il vaccino BNT162b2 in bambini di età compresa tra 12 e 17 anni e segnali di convulsioni/convulsioni sono stati rilevati dopo la vaccinazione con BNT162b2 e mRNA-1273 in bambini di età compresa tra 2-4/5 anni. Tuttavia, in un’analisi di sensibilità post-hoc, il segnale di crisi epilettiche/convulsioni era sensibile alla selezione dei tassi di fondo e non è stato osservato quando sono stati selezionati i tassi di fondo del 2022 invece dei tassi del 2020.
Conclusioni e rilevanza Dei due esiti segnalati, i segnali di miocardite o pericardite sono coerenti con i rapporti pubblicati in precedenza. Il nuovo segnale rilevato per crisi epilettiche/convulsioni tra i bambini più piccoli dovrebbe essere ulteriormente studiato in un robusto studio epidemiologico con un migliore aggiustamento dei fattori di confondimento.
Punti chiave
Domanda
Il monitoraggio attivo ha rilevato segnali statistici sugli esiti sanitari a seguito della vaccinazione monovalente contro il COVID-19 nei bambini statunitensi di età compresa tra 6 mesi e 17 anni?
Risultati
In questo studio che includeva 4.102.106 iscritti vaccinati da tre database di richieste commerciali, miocardite o pericardite sono state segnalate dopo le vaccinazioni BNT162b2 (12-17 anni) ed è stato rilevato un nuovo segnale per crisi epilettiche/convulsioni dopo le vaccinazioni BNT162b2 (2-4 anni) e mRNA1273 COVID-19 ( 2-5 anni).
Senso
Il monitoraggio quasi in tempo reale dei vaccini può identificare rapidamente potenziali problemi di sicurezza. Sebbene il segnale di miocardite o pericardite sia coerente con le prove esistenti, il nuovo segnale di crisi epilettiche/convulsioni deve essere interpretato con cautela date le limitazioni dello studio.
introduzione
Tre vaccini contro il COVID-19 sono attualmente disponibili per l’uso nei bambini negli Stati Uniti (USA), inclusi i vaccini mRNA Pfizer-BioNTech (BNT162b2) e Moderna (mRNA-1273) contro il COVID-19 per i soggetti di età compresa tra 6 mesi e 17 anni e il vaccino Novavax COVID-19 a base proteica (NVX-CoV2373) per i soggetti di età compresa tra 12 e 17 anni. 1 – 3 A maggio 2023, i Centri per il controllo e la prevenzione delle malattie (CDC) hanno riferito che 31,78 milioni di bambini avevano ricevuto almeno una dose di vaccino COVID-19 e 26,2 milioni di bambini avevano completato la serie primaria su circa 73 milioni di bambini di età compresa tra 6 mesi a 17 anni negli Stati Uniti. 4 La Food and Drug Administration (FDA) statunitense, utilizzando l’iniziativa Biologics Effectiveness and Safety (BEST), ha monitorato la sicurezza dei vaccini COVID-19 nei bambini sin dalla loro autorizzazione, applicando un quadro di monitoraggio quasi in tempo reale per valutare la sicurezza dei vaccini anti-COVID-19. Questo processo è un metodo di rilevamento o screening del segnale e il primo passo nel monitoraggio della sicurezza di questi vaccini. Questa struttura è progettata per essere sufficientemente sensibile da rilevare rapidamente segnali di sicurezza meno comuni. Tuttavia, i risultati di tale disegno di studio non stabiliscono una relazione causale tra i vaccini e gli esiti sanitari e devono essere interpretati con cautela a causa del limitato aggiustamento per fattori di confondimento e altre forme di bias.
L’analisi BEST dei vaccini COVID-19 nei bambini si è inizialmente concentrata sul vaccino monovalente BNT162b2 COVID-19 autorizzato per l’uso nei bambini di età compresa tra 5 e 17 anni. Da allora la sorveglianza è stata ampliata man mano che ulteriori gruppi di età pediatrica e marchi di vaccini hanno ricevuto l’autorizzazione fino alla fine del 2022. I risultati della sorveglianza di sicurezza iniziale, più limitata, nei bambini sono stati precedentemente pubblicati. 5 In questo rapporto presentiamo i risultati del monitoraggio ampliato degli esiti sanitari nei bambini dopo l’esposizione ai vaccini monovalenti ancestrali contro il COVID-19 negli Stati Un Uniti mirati al ceppo originale del COVID-19.
Metodi
Obiettivo dello studio
Questo studio ha valutato 21 risultati sanitari pre-specificati dopo l’esposizione ai vaccini monovalenti COVID-19 BNT162b2, mRNA-1273 o NVX-CoV2373 in bambini di età compresa tra 6 mesi e 17 anni applicando un quadro di monitoraggio quasi in tempo reale utilizzando i dati sanitari di tre database di reclami commerciali negli Stati Uniti. Quindici risultati sono stati sottoposti a test sequenziali e 6 risultati sono stati monitorati solo in modo descrittivo a causa della mancanza di tassi storici.
Origine dei dati
Lo studio ha utilizzato dati sulle richieste amministrative commerciali di Optum, Carelon Research e CVS Health contenenti dati longitudinali sulle richieste mediche e farmaceutiche integrati con dati sulle vaccinazioni provenienti dai sistemi informativi di immunizzazione (IIS) locali e statali partecipanti (Tabella supplementare 1). 6
Popolazione e periodo di studio
Lo studio ha incluso arruolati pediatrici di età compresa tra 6 mesi e 17 anni che hanno ricevuto un vaccino monovalente contro il COVID-19 dalla prima data di autorizzazione all’uso di emergenza per fascia di età fino ad aprile 2023 (Optum), marzo 2023 (Carelon Research) e febbraio 2023 (CVS). Salute) (Tabella supplementare 2). La sorveglianza si è conclusa in queste rispettive date a causa del limitato accumulo di esposizioni e di esiti sanitari. Le analisi sequenziali per la maggior parte dei risultati non hanno raggiunto il numero previsto di eventi pre-specificato sulla base della prevista adesione alla vaccinazione in un periodo di 6 mesi successivo all’autorizzazione dei singoli prodotti vaccinali. Un altro fattore che ha contribuito all’interruzione della sorveglianza è stata la revoca dell’autorizzazione delle dosi monovalenti originali di mRNA-1273 e BNT162b2 per persone di tutte le età il 18 aprile 2023.7
I criteri di inclusione per lo studio includevano l’iscrizione alla data di vaccinazione e l’iscrizione continua a un piano di assicurazione sanitaria medica partecipante dall’inizio di una finestra pulita specifica per l’esito fino alla data di vaccinazione per il COVID-19, in modo che solo una nuova diagnosi incidente di un esito nello studio la finestra di rischio post-vaccinazione contribuirebbe all’analisi (Tabella supplementare 3).
Esposizioni e follow-up
L’esposizione è stata definita come la ricezione di una dose di vaccino monovalente COVID-19 BNT162b2, mRNA-1273 o NVX-CoV2373 identificata utilizzando i codici 8 della terminologia procedurale corrente/sistema di codifica delle procedure sanitarie comuni specifici per marca e dose e i codici nazionali dei farmaci (Tabella supplementare 4 ) ). Il numero di dose è stato assegnato in base all’ordine cronologico in cui sono state osservate le vaccinazioni poiché i codici di somministrazione non erano disponibili nelle indicazioni in farmacia. Le analisi primarie includevano tutto il tempo di follow-up maturato dopo la dose 1 e la dose 2 combinate. Le analisi secondarie includevano la stratificazione in base al numero di dosi e al tempo di follow-up maturato dopo la dose individuale (comprese le terze dosi monovalenti/di richiamo) attraverso la censura alla successiva vaccinazione, morte, abbandono, fine della finestra di rischio o fine del periodo di studio.
Risultati sulla salute
Ventuno risultati sanitari pre-specificati sono stati definiti utilizzando algoritmi basati sulle richieste 9 – 10 . I risultati sono stati selezionati attraverso la consultazione clinica e la revisione della letteratura. Quindici risultati sanitari sono stati valutati utilizzando test sequenziali confrontando i tassi con i tassi di risultati storici (ulteriori informazioni sui tassi storici di seguito) e 6 sono stati monitorati solo in modo descrittivo a causa della mancanza di tassi storici. 10 L’esito miocardite, pericardite o miocardite e pericardite concomitanti (di seguito denominate miocardite/pericardite) è stato valutato utilizzando quattro diverse definizioni con diverse finestre di rischio e impostazioni di cura (incluse nella Tabella supplementare 3) sulla base delle evidenze derivanti da precedenti sforzi di sorveglianza e input clinici.
Monitoraggio descrittivo
Abbiamo stimato i tassi di esito nella popolazione vaccinata stratificati per età, sesso, regione, stato urbano/rurale, fonte di dati e marca del vaccino su base mensile.
Test sequenziali
Sono stati condotti test sequenziali mensili utilizzando il test del rapporto di probabilità sequenziale massimizzato di Poisson (PMaxSPRT) per rilevare segnali statistici generando il rapporto del tasso di incidenza (IRR) confrontando i tassi di esito successivi alla vaccinazione con i tassi storici (attesi) specifici del database per 15 esiti sanitari. 11
Abbiamo stimato i tassi storici annuali per il 2019 e il 2020, nonché durante la pandemia di COVID-19 tra aprile e dicembre 2020. I tassi storici sono stati adeguati per il ritardo nell’elaborazione delle richieste per tenere conto del ritardo nell’osservazione e standardizzati per età e sesso laddove il conteggio dei casi era consentito. 12 La selezione del tasso di confronto storico si è basata sulla sovrapposizione tra gli intervalli di confidenza (IC) al 95% per i periodi precedenti e durante la pandemia di COVID-19. Se i tassi in questi due periodi storici differivano sostanzialmente, abbiamo selezionato il tasso minimo o quello più stabile come approccio più conservativo.
I test sono stati stratificati per età in base alle autorizzazioni specifiche per gruppo di età per marca di vaccino, nonché alla disponibilità di tassi di base utilizzando dati comparativi storici. Per BNT162b2, questa includeva età 6 mesi-4 anni, 6 mesi-1 anno e 2-4 anni (solo per crisi epilettiche/convulsioni), 5-11 anni, 12-15 anni e 16-17 anni. Per l’mRNA-1273, questo includeva 6 mesi-5 anni, 6 mesi-1 anno e 2-5 anni (solo per crisi epilettiche o convulsioni), 6-11 anni, 12-15 anni e 16-17 anni. Per NVX-CoV2373, le fasce di età erano 12-15 anni e 16-17 anni.
I test sequenziali per ciascun risultato sono iniziati quando un minimo di tre casi si sono accumulati nella finestra di rischio. Sono stati utilizzati test a una coda con l’ipotesi nulla che il tasso osservato non fosse maggiore del tasso storico del comparatore oltre un margine di test pre-specificato per ciascun gruppo di risultato-dose-età testato in sequenza, con un livello alfa dell’1%. È stato selezionato un livello alfa rigoroso per aumentare la specificità dei segnali rilevati dal test di più risultati in diverse analisi. Il rapporto di verosimiglianza logaritmica è stato calcolato confrontando la probabilità dell’IRR osservato e l’ipotesi nulla.
Ad ogni test, se il rapporto di verosimiglianza superava un valore critico pre-specificato, l’ipotesi nulla veniva rifiutata e veniva dichiarato un segnale. La sorveglianza è continuata fino al rilevamento di un segnale, al raggiungimento della durata massima di sorveglianza specificata o alla fine del periodo di studio. 10
Caratterizzazione del segnale
La caratterizzazione del segnale è stata condotta dopo l’identificazione di un segnale per fornire una valutazione della qualità dei dati. 13 Abbiamo condotto controlli di qualità per escludere errori del database o cambiamenti nei modelli di codici diagnostici utilizzati per identificare gli eventi nel periodo di studio; stimato il rischio relativo di esiti all’interno degli strati demografici per età e sesso; esaminato i tempi in cui si verificano gli esiti durante la finestra di rischio prestabilita; e ha valutato se il segnale fosse sensibile ai cambiamenti nella selezione dei tassi di fondo conducendo un’analisi di sensibilità post-hoc utilizzando i tassi di fondo aggiornati al 2022 come comparatore storico nei test sequenziali.
Revisione della cartella clinica
È stata condotta una revisione della cartella clinica per l’esito di miocardite/pericardite in seguito all’identificazione di un segnale. Per giudicare i casi sono state utilizzate le definizioni dei casi della Brighton Collaboration. 14 I record che soddisfacevano le classificazioni Brighton confermate o probabili sono stati considerati veri casi di miocardite/pericardite per le analisi di validazione.
Risultati
Monitoraggio descrittivo
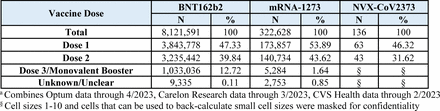
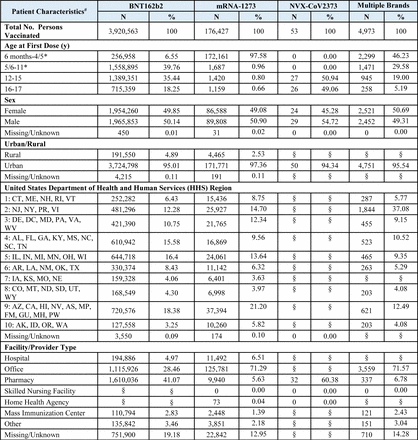
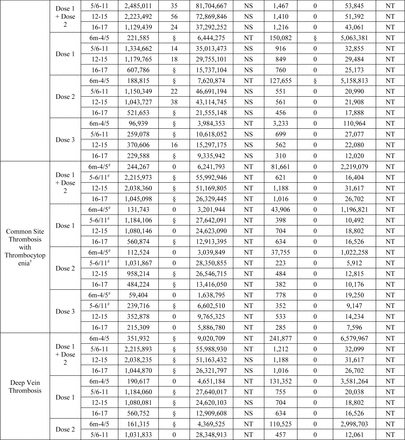
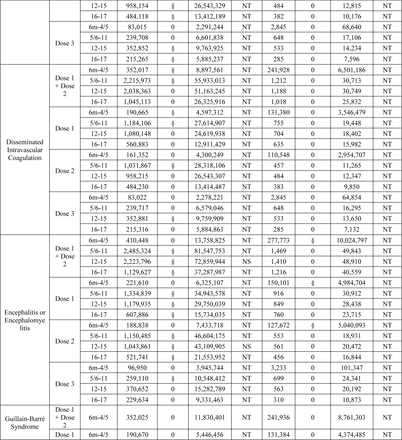
Un totale di 8.444.355 dosi di vaccino monovalente COVID-19 sono state somministrate a 4.102.016 iscritti di età compresa tra 6 mesi e 17 anni ( Figura 1 ). Ciò includeva 8.121.591 dosi di BNT162b2 (Dose 1: 3.843.778, Dose 2: 3.235.442, Dose 3/Booster monovalente: 1.033.036 e Sconosciuto/Non chiaro: 9.335) e 322.628 dosi di mRNA-1273 (Dose 1: 173.857, Dose 2: 140.734, Dose 3/ Richiamo monovalente: 5.284 e Sconosciuto/Non chiaro: 2.753) somministrati a bambini di età compresa tra 6 mesi e 17 anni, nonché 136 dosi di NVX-CoV2373 (Dose 1: 63, Dose 2: 43, Dose 3/Richiamo monovalente e Sconosciuto/Non chiaro: 30) somministrato a bambini di età compresa tra 12 e 17 anni ( Tabella 1a ). Le caratteristiche demografiche della popolazione vaccinata, ad eccezione dell’età riportata alla prima dose, erano in gran parte simili tra le marche di vaccini. Mentre la maggioranza (93,4%) degli individui vaccinati con BNT162b2 aveva 5 anni o più; la maggioranza (97,6%) degli individui vaccinati con mRNA-1273 aveva meno di 5 anni. Tra tutti i marchi di vaccini, 2.058.142 (50,2%) erano maschi e 3.901.370 (95,2%) vivevano in un’area urbana ( Tabella 1b ). Abbiamo osservato un numero basso di casi per i risultati monitorati solo in modo descrittivo (<80 casi di qualsiasi risultato in tutti e tre i database combinati) (Tabella supplementare 5).
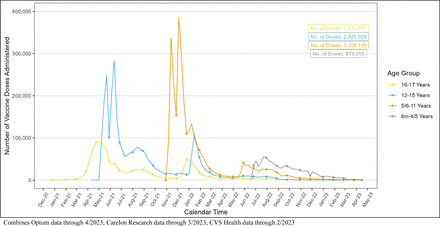
Figura 1
Distribuzione delle dosi monovalenti dei vaccini COVID-19 BNT162b2, mRNA-1273 e NVX-CoV2373 somministrati nel tempo per gruppo di età, tutte le fonti di dati
Test sequenziali
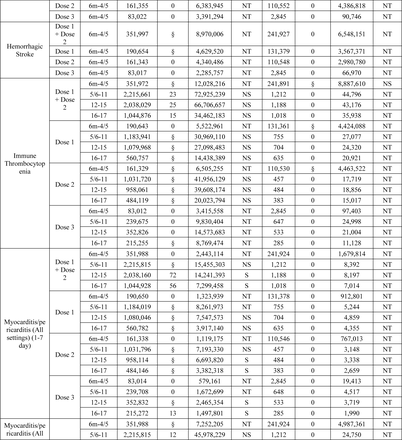
Tra i 15 esiti testati in sequenza, due esiti hanno raggiunto la soglia statistica per un segnale che includeva miocardite/pericardite nelle età di 12-15 e 16-17 anni e crisi epilettiche/convulsioni nelle età di 2-4/5 anni.
Miocardite/pericardite è stata segnalata per tutte le definizioni nell’analisi primaria dopo la vaccinazione BNT162b2 COVID-19 tra i bambini di età compresa tra 12-15 e 16-17 anni in tutti e tre i database. Inoltre, segnali dose-specifici per una o più definizioni degli esiti sono stati rilevati in età di 12-17 anni dopo la dose 1, la dose 2 e la dose 3 del vaccino BNT162b2 in almeno uno dei tre database (Tabella 2 ) .
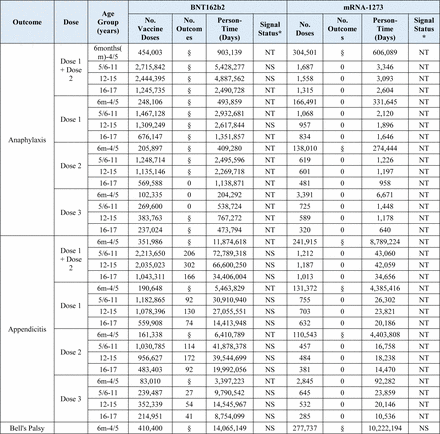
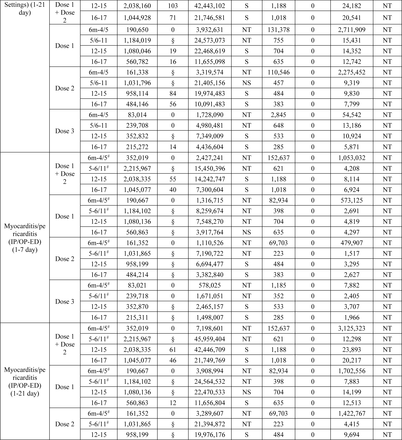
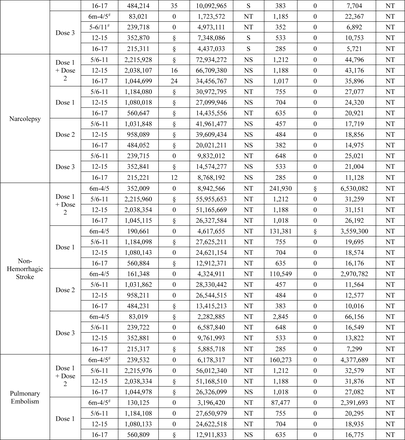
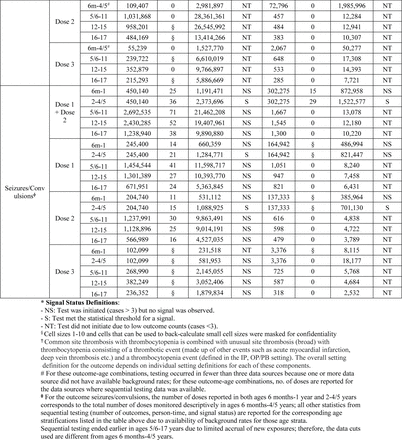
Nell’analisi primaria, crisi epilettiche/convulsioni hanno raggiunto la soglia statistica per un segnale nei bambini di età compresa tra 2 e 4 anni dopo la vaccinazione con BNT162b2 in tutti e tre i database e nei bambini di età compresa tra 2 e 5 anni dopo la vaccinazione con mRNA-1273 in due dei tre database. Segnali dose-specifici per attacchi epilettici/convulsioni sono stati rilevati in due dei tre database dopo la vaccinazione con dose 1 e dose 2 con BNT162b2 in età di 2-4 anni e dopo la vaccinazione con dose 2 con mRNA-1273 in età di 2-5 anni (Tabella 2 ) .
I test sequenziali non sono stati avviati per nessuno dei 15 risultati per mRNA-1273 in età compresa tra 5 e 17 anni e NVX-CoV2373 in età compresa tra 12 e 17 anni, poiché non è stato osservato alcun risultato in nessun database.
Caratterizzazione del segnale
Poiché la miocardite/pericardite è un esito avverso noto a seguito delle vaccinazioni con mRNA di COVID-19, non sono state condotte ulteriori attività di caratterizzazione del segnale. Nella valutazione del segnale di attacchi/convulsioni tra i bambini di età compresa tra 2-4/5 anni, nessuno dei controlli di qualità dei dati pre-specificati, inclusa la duplicazione delle richieste, la tempistica degli eventi all’interno della finestra di rischio pre-specificata e le stime dell’IRR, hanno sollevato dati preoccupazioni sulla qualità.
Sono stati osservati 72 casi di crisi epilettiche/convulsioni tra bambini di età compresa tra 2 e 4/5 anni e più del 50% di questi casi soddisfaceva la definizione di convulsioni febbrili. Non sono state identificate differenze nei tassi di crisi epilettiche/convulsioni in base al sesso. La tempistica dei casi non ha indicato un sostanziale raggruppamento di casi distribuiti nella finestra di rischio da 0 a 7 giorni; Il 31,9% dei casi di crisi epilettiche/convulsioni si è verificato entro 0-1 giorni successivi alla vaccinazione COVID-19. Il tempo mediano tra la vaccinazione e la diagnosi di crisi epilettiche/convulsioni è stato di 2 giorni. (Figura supplementare 1).
Il segnale di attacchi/convulsioni era sensibile ai cambiamenti nella selezione dei tassi di confronto. La valutazione del tasso di fondo annuale di crisi epilettiche/convulsioni ha indicato che i tassi utilizzati nelle analisi primarie (2020) erano sostanzialmente inferiori ai tassi del 2022. I tassi di fondo nel 2022 variavano da circa 2,2-2,4 volte i tassi del 2020 in tre database (tabella supplementare 6). Un’analisi di sensibilità post-hoc utilizzando i tassi di fondo del 2022 come comparatore nei test sequenziali non ha identificato alcun segnale di attacchi/convulsioni.
Revisione della cartella clinica
Dei 153 casi di miocardite/pericardite dopo la vaccinazione COVID-19 tra bambini di età compresa tra 12 e 17 anni, è stata condotta una revisione della cartella clinica per un campione di 40 casi di cui è stato possibile ottenere la documentazione. Ventinove di questi casi (72,5%) sono stati confermati come veri casi di miocardite/pericardite, di cui 27 pazienti erano di sesso maschile e 19 sono stati ospedalizzati con una durata media di degenza ospedaliera di 2 giorni (intervallo interquartile: 1, 3). Il tempo mediano dalla vaccinazione alla presentazione dell’evento di miocardite/pericardite è stato di 3 giorni (intervallo interquartile: 2, 5). Sono attualmente in corso la revisione delle cartelle cliniche e ulteriori sforzi di validazione per attacchi epilettici/convulsioni.
Discussione
Il nostro monitoraggio quasi in tempo reale di 21 esiti sanitari pre-specificati a seguito di vaccini monovalenti contro COVID-19 ha rilevato segnali di miocardite/pericardite nella fascia di età 12-17 anni e convulsioni/convulsioni nella fascia di età 2-4/5 anni. Non abbiamo rilevato segnali per altri risultati che sono stati testati in sequenza.
Il segnale di miocardite/pericardite è coerente con i rapporti di pubblicazioni sottoposte a revisione paritaria che dimostrano un rischio elevato di questo esito in seguito ai vaccini a mRNA tra i maschi più giovani di età compresa tra 12 e 29 anni. 15 – 17 La miocardite/pericardite è un evento raro con un’incidenza media segnalata di 39,3 casi per milione di dosi di vaccino somministrate a bambini di età compresa tra 5 e 17 anni entro 7 giorni dalla vaccinazione con BNT162b2. 18 – 19 Non abbiamo rilevato un segnale di miocardite/pericardite nei bambini di età inferiore a 12 anni che sia coerente con i rapporti di altri sistemi di sorveglianza. 20 – 21
Il segnale di crisi epilettiche/convulsioni nei bambini di età compresa tra 2-4/5 anni non è stato precedentemente riportato per questa fascia di età negli studi di sorveglianza attiva dei vaccini mRNA COVID-19. Tuttavia, esistono segnalazioni dal database VAERS (Vaccine Adverse Events Reporting System) che è un sistema di segnalazione passivo e presenta delle limitazioni. In un’analisi dei dati VAERS, sono state identificate solo 8 crisi epilettiche a seguito di circa un milione di vaccinazioni con mRNA fino ad agosto 2022 nella fascia di età compresa tra 6 mesi e 5 anni. Sei delle 8 crisi epilettiche erano afebbrili alla valutazione medica. 22 I dati sulla sicurezza dei vaccini pre-autorizzazione indicano che tra i bambini piccoli, le crisi epilettiche/convulsioni a seguito dei vaccini mRNA COVID-19 sono rari; Uno studio clinico su 3.013 destinatari del vaccino BNT162b2 in bambini di età compresa tra 6 mesi e 4 anni ha riportato solo 5 casi di convulsioni febbrili e solo uno di questi (in un partecipante di 6 mesi) è stato considerato possibilmente correlato al vaccino o potrebbe anche essere stato causato da una concomitante infezione virale. 23 Tra gli studi condotti su bambini affetti da epilessia infantile (<18 anni), non è stato identificato alcun aumento del rischio di convulsioni assistite dal medico in seguito all’immunizzazione con vaccini COVID-19. Il rischio di convulsioni dopo la vaccinazione contro il COVID-19 era inferiore nei bambini che erano liberi da convulsioni per più di sei mesi prima della vaccinazione. Tuttavia, l’incidenza di eventi avversi generali dopo la vaccinazione è stata bassa e non sono stati registrati eventi avversi gravi. 24-25 In generale, esistono prove limitate che colleghino i vaccini mRNA COVID-19 all’insorgenza di convulsioni tra i bambini vaccinati di età compresa tra 2-4/5 anni .
Il nuovo segnale di crisi epilettiche/convulsioni osservato nel nostro studio dovrebbe essere interpretato con cautela e ulteriormente indagato in uno studio epidemiologico più robusto. Il nostro studio ha utilizzato un’ampia definizione di esito di crisi epilettiche/convulsioni con una finestra di rischio di 0-7 giorni a causa della sua applicabilità ai bambini più grandi. Tuttavia, nei bambini di età inferiore ai 5 anni, le convulsioni correlate al vaccino si manifestano tipicamente come convulsioni febbrili. 26 Sebbene la maggior parte dei casi di crisi epilettiche/convulsioni soddisfacesse la definizione di convulsioni febbrili, non è stato osservato alcun clustering statisticamente significativo nei giorni 0-1. Poiché le convulsioni febbrili possono essere comuni nei bambini piccoli per una serie di motivi; l’analisi potrebbe aver identificato convulsioni febbrili non correlate alla vaccinazione più avanti nella finestra di rischio.
Le analisi di sensibilità post-hoc utilizzando i tassi di fondo del 2022 come comparatori nei test sequenziali non hanno prodotto alcun segnale di attacchi/convulsioni che suggerisca che i nostri risultati siano sensibili alla selezione del tasso di confronto. La decisione di utilizzare i tassi di crisi/convulsioni del 2020 come comparatori è stata quella di massimizzare la sensibilità nell’analisi primaria. Tuttavia, i tassi di crisi epilettiche/convulsioni in questa fascia di età nel 2022 erano due volte più alti rispetto ai tassi del 2020. Potrebbero esserci un paio di potenziali ragioni per tassi di esito elevati nel 2022 rispetto al 2020. In primo luogo, vi è stata una maggiore incidenza di infezioni respiratorie (influenza e virus respiratorio sinciziale) che si sono dimostrate associate a convulsioni febbrili nei bambini più piccoli, durante il periodo di studio (da metà 2022 a metà 2023) rispetto al 2020. 27 – 30 In secondo luogo, nel 2020, ci sono state probabilmente meno visite al pronto soccorso per eventi correlati alle convulsioni rispetto al 2022 a causa delle limitazioni delle risorse sanitarie legate alla pandemia di COVID-19. 31
Il nostro studio ha una serie di punti di forza. Innanzitutto, lo studio ha incluso una popolazione ampia e geograficamente diversificata proveniente da tre database di assicurazioni sanitarie commerciali statunitensi. A causa della disponibilità di informazioni più complete dalle richieste integrate con i dati IIS e di un breve ritardo nei dati rispetto agli incontri sanitari, abbiamo monitorato la sicurezza dei vaccini monovalenti contro il COVID-19 quasi in tempo reale. Inoltre, un sottogruppo dei casi di miocardite/pericardite identificati è stato confermato attraverso la revisione della cartella clinica.
Lo studio presenta anche alcune limitazioni. Abbiamo utilizzato un metodo di sorveglianza quasi in tempo reale che può essere sensibile alla selezione del tasso di confronto e non include il controllo di bias e confondimenti. Pertanto, i risultati di questo studio non stabiliscono una relazione causale tra i vaccini e gli esiti sanitari e i segnali dovrebbero essere ulteriormente valutati. In secondo luogo, questo studio include solo dati provenienti da una popolazione pediatrica assicurata commercialmente e potrebbe non essere rappresentativo a livello nazionale. Inoltre, lo studio potrebbe avere un potere limitato nel rilevare piccoli aumenti del rischio di esiti in alcuni sottogruppi o nei casi di vaccini autorizzati più recentemente, come NVX-CoV2373 nei bambini di età compresa tra 12 e 17 anni e mRNA-1273 in quelli di età compresa tra 12 e 17 anni. 5-17 anni.
Conclusione
Il nostro studio ha rilevato un segnale di miocardite/pericardite nei bambini più grandi che è coerente con la letteratura esistente, e un nuovo segnale di crisi epilettiche/convulsioni nei bambini piccoli che è in fase di ulteriore valutazione in uno studio più approfondito. La FDA conclude che i benefici noti e potenziali della vaccinazione contro il COVID-19 superano i rischi noti e potenziali dell’infezione da COVID-19. Questo studio è stato condotto nell’ambito dell’iniziativa BEST della FDA, che svolge un ruolo importante nei più ampi sforzi di monitoraggio della sicurezza dei vaccini del governo federale degli Stati Uniti e supporta ulteriormente il processo decisionale normativo relativo ai vaccini COVID-19.
Finanziatore
La Food and Drug Administration statunitense ha fornito finanziamenti per questo studio e ha contribuito come segue: ha guidato la progettazione dello studio, l’interpretazione dei risultati, la stesura del manoscritto, la decisione di sottoporlo e ha contribuito al coordinamento della raccolta dei dati e dell’analisi dei dati. dati.
Contributi aggiuntivi
Ringraziamo Tainya C. Clarke, Sylvia Cho e Carla E. Zelaya della Food and Drug Administration statunitense; Anchi Lo, Bing Lyu, Nimesh Shah, Derek Phan, Gyanada Acharya, Kamakshi Sirpal, Laurie Feinberg, Lloyd Marks, Minisha Kochar, Sandia Akhtar, Shruti Parulekar, Stella Zhu, William (Trey) Minter, Yeerae Kim, Yixin Jiao e Zhiruo (Cassie) Pallido di acume; Nancy B Shaik, Ana M Martinez-Baquero, Smita Bhatia, Vaibhav Sharma, Carla Brannan di CVS Health e Charlalynn Harris e Danielle Cooper ex CVS Health; Shiva Vojjala, Ramya Avula, Shiva Chaudhary, Shanthi P Sagare, Ramin Riahi, Navyatha Namburu e Grace Stockbower di Carelon Research; Michael Goodman, Michael Bruhn e Ruth Weed di IQVIA; Grace Yang, Sarah Sargen, Alexandra Stone, Wafa Tarazi, Megan Ketchell, Kathryn Federici, Amaka Ume, Emily Myers, Eli Wolter, Jackson Slaney, Bobby Smith, Lauren Peetluk ed Elizabeth Bell degli Optum.
Ringraziamenti
Riferimenti
1. ↵FDA . ( 2022 , 30 giugno). Vaccini Covid-19 . Amministrazione statunitense per gli alimenti e i farmaci . Estratto da http://www.fda.gov/emergency-preparedness-and-response/coronavirus-emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/covid-19-vaccines#authorized-vaccinesGoogle Scholar
2.Centri per il controllo e la prevenzione delle malattie . ( 2022 , 18 giugno). Il CDC raccomanda i vaccini anti-COVID-19 per i bambini piccoli . Centri per il controllo e la prevenzione delle malattie . Estratto da https://www.cdc.gov/media/releases/2022/s0618-children-vaccine.htmlGoogle Scholar
3. ↵Amministrazione statunitense per gli alimenti e i farmaci . ( 2022 , 19 agosto). Vaccini Covid-19 . Estratto il 24 agosto 2022 da https://www.fda.gov/media/159902/downloadGoogle Scholar
4. ↵Centri per il controllo e la prevenzione delle malattie. Monitoraggio dei dati COVID r. Atlanta, Georgia : UUUU.S. Dipartimento della Salute e dei Servizi Umani, CDC ; 2023 , 11 luglio. https://covid.cdc.gov/covid-data-trackerGoogle Scholar
5. ↵Hu M , Wong HL , Feng Y , et al. Sicurezza del vaccino BNT162b2 COVID-19 nei bambini di età compresa tra 5 e 17 anni . JAMA Pediatr. Pubblicato online il 22 maggio 2023 . Doi: 10.1001/jamapediatrics.2023.1440 Rif. CroceGoogle Scholar
6. ↵Centri per il controllo e la prevenzione delle malattie . ( 2019 , 7 giugno). Sistemi informativi sull’immunizzazione (IIS). Centri per il controllo e la prevenzione delle malattie . Estratto da https://www.cdc.gov/vaccines/programs/iis/index.htmlGoogle Scholar
7. ↵Commissario, O. Aggiornamento sul coronavirus (COVID-19): la FDA autorizza modifiche per semplificare l’uso dei vaccini bivalenti mrna COVID-19, Stati Uniti . Amministrazione degli alimenti e dei farmaci. Estratto da https://www.fda.gov/news-events/press-announcements/coronavirus-covid-19-update-fda-authorizes-changes-simplify-use-bivalent-mrna-covid-19-vaccinesGoogle Scholar
8. ↵Licenza per l’uso della terminologia procedurale corrente, quarta edizione (“Cpt®”) CMS.gov . Disponibile all’indirizzo: https://www.cms.gov/license/ama?file=%2Ffiles%2Fzip%2Flist-codes-effect-january-1-2023-published-december-1-2022.zip (accesso effettuato: 31 agosto 2023).Google Scholar
9. ↵Centro per la valutazione e la ricerca biologica, iniziativa BEST. Supplemento al protocollo di sicurezza del vaccino COVID-19 . Pubblicato nel 2021. https://bestinitiative.org/vaccines-and-allergenicsGoogle Scholar
10. ↵Centro per la valutazione e la ricerca biologica, Iniziativa BEST (2022, 12 dicembre) . Iniziativa sull’efficacia e la sicurezza dei prodotti biologici del programma di sorveglianza CBER , estratto da https://bestinitiative.org/wp-content/uploads/2022/12/C19-Active-Monitoring-Protocol-Addendum-2022.pdf .Google Scholar
11. ↵Kulldorff , M. , et al. Un test del rapporto di probabilità sequenziale massimizzato per la sorveglianza della sicurezza di farmaci e vaccini . Analisi sequenziale , 2011 . 30 ( 1 ): pag. 58 – 78Rif. CroceGoogle Scholar
12. ↵Centro per la valutazione e la ricerca biologica, iniziativa BEST (2021, 12 gennaio). Tassi di fondo di eventi avversi di particolare interesse per il monitoraggio della sicurezza dei vaccini COVID-19 , estratto da https://www.bestinitiative.org/wp-content/uploads/2022/01/C19-Vax-Safety-AESI-Bkgd-Rate- Protocollo-FINAL-2020.pdfGoogle Scholar
13. ↵13. Wong, H.-L., et al. ( 2023 ) Sorveglianza della sicurezza del vaccino covid-19 tra gli anziani di età pari o superiore a 65 anni, Vaccine . Disponibile all’indirizzo: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9712075/ (Accesso: 8 giugno 2023).Google Scholar
14. ↵ Sexson Tejtel , SK , Munoz , FM , Al-Ammouri , I. , Savorgnan , F. , Guggilla , RK , Khuri-Bulos , N. , Phillips , L. , & Engler , R. ( 2022 ). Miocardite e pericardite: definizione del caso e linee guida per la raccolta, l’analisi e la presentazione dei dati sulla sicurezza dell’immunizzazione . Vaccino , 40 ( 10 ), 1499 – 1511 . doi: 10.1016/j.vaccine.2021.11.074 Rif. CrocePubMedGoogle Scholar
15. ↵Witberg G , Barda N , Hoss S , et al. Miocardite dopo la vaccinazione contro il Covid-19 in una grande organizzazione sanitaria . N inglese J Med . 2021 ; 385 ( 23 ): 2132 – 2139PubMedGoogle Scholar
16.Gargano JW , Wallace M , Hadler SC , et al. Uso del vaccino mRNA COVID-19 dopo segnalazioni di miocardite tra i destinatari del vaccino: aggiornamento del comitato consultivo sulle pratiche di immunizzazione – Stati Uniti , giugno 2021. MMWR Morb Mortal Wkly Rep . 2021 ; 70 ( 27 ): 977 – 982Rif. CrocePubMedGoogle Scholar
17. ↵Nygaard U , Holm M , Bohnstedt C , et al. Incidenza di miopericardite basata sulla popolazione dopo la vaccinazione COVID-19 negli adolescenti danesi . Pediatr Infect Dis J . 2022 ; 41 ( 1 ): e25 – e28PubMedGoogle Scholar
18. ↵Centri per il controllo e la prevenzione delle malattie . ( 2022 , 3 giugno). Considerazioni cliniche: miocardite e pericardite dopo la ricezione dei vaccini mRNA COVID-19 tra adolescenti e giovani adulti . Centri per il controllo e la prevenzione delle malattie . Estratto il 12 agosto 2022 da https://www.cdc.gov/vaccines/covid-19/clinical-considerations/myocarditis.htmlGoogle Scholar
19. ↵Shimabukuro , T.T. _ ( 2022 ). Aggiornamento sulla miocardite a seguito della vaccinazione mRNA COVID-19 .Google Scholar
20. ↵Hause , AM , Baggs , J. , Marquez , P. , Myers , TR , Gee , J. , Su , JR , … & Shay , DK ( 2021 ). Sicurezza del vaccino COVID-19 nei bambini di età compresa tra 5 e 11 anni: Stati Uniti, 3 novembre – 19 dicembre 2021 . Rapporto settimanale sulla morbilità e mortalità , 70 ( 51-52 ), 1755 .Google Scholar
21. ↵Woodworth , KR , Moulia , D. , Collins , JP , Hadler , SC , Jones , JM , Reddy , SC , … & Oliver , SE ( 2021 ). Raccomandazione provvisoria del comitato consultivo sulle pratiche di immunizzazione per l’uso del vaccino Pfizer-BioNTech COVID-19 nei bambini di età compresa tra 5 e 11 anni: Stati Uniti, novembre 2021 . Rapporto settimanale su morbilità e mortalità , 70 ( 45 ), 2020.Google Scholar
22. ↵Hause AM , Marquez P , Zhang B , et al. Sicurezza del vaccino mRNA contro il COVID-19 tra i bambini di età compresa tra 6 mesi e 5 anni – Stati Uniti, 18 giugno 2022 – 21 agosto 2022 . MMWR Morb Mortal Wkly Rep 2022 ; 71 : 1115 – 1120 . DOI: 10.15585/mmwr.mm7135a3 . Rif. CroceGoogle Scholar
23. ↵Amministrazione degli alimenti e dei farmaci degli Stati Uniti. Riunione del comitato consultivo sui vaccini e sui prodotti biologici correlati, 15 giugno 2022, documento informativo della FDA: richiesta di modifica dell’EUA per il vaccino Pfizer-BioNTech COVID-19 da utilizzare nei bambini di età compresa tra 6 mesi e 4 anni . 2022 . (Accesso 7 dicembre 2022). https://www.fda.gov/media/159195/downloadGoogle Scholar
24. ↵Wang Z , Fang X , et al. Sicurezza e tollerabilità del vaccino COVID-19 nei bambini affetti da epilessia: uno studio prospettico multicentrico . Pediatr Neurol . 2023 marzo ; 140 : 3-8 ._ _ doi: 10.1016/j.pediatrneurol.2022.11.018 Epub 2022 dicembre 5. PMID: 36577181 ; ID PMC: PMC9721163 . Rif. CrocePubMedGoogle Scholar
25. ↵Yang X , Wu L , et al. Vaccinazione COVID-19 per pazienti con epilessia infantile benigna con picchi centrotemporali . Comportamento dell’epilessia . 2022 settembre ; 134 : 108744 . doi: 10.1016/j.yebeh.2022.108744 Epub 2022 17 maggio. PMID: 35952506 ; ID PMC: PMC9110311 . Rif. CrocePubMedGoogle Scholar
26. ↵Kawai , AT , Martin , D. , Henrickson , SE , Goff , A. , Reidy , M. , Santiago , D. , Selvam , N. , Selvan , M. , McMahill-Walraven , C. , & Lee , G. M. _ ( 2019 ). Convalida delle convulsioni febbrili identificate nel programma di monitoraggio della sicurezza dell’immunizzazione rapida post-autorizzazione Sentinel . Vaccino , 37 ( 30 ), 4172 – 4176 . doi: 10.1016/j.vaccine.2019.05.042 Rif. CroceGoogle Scholar
27. ↵Centri per il controllo e la prevenzione delle malattie . ( 2022 , 14 ottobre). Il CDC segnala i primi aumenti dell’attività influenzale stagionale . Centri per il controllo e la prevenzione delle malattie . https://www.cdc.gov/flu/spotlights/2022-2023/early-flu-activity.htm#:~:text=October%2014%2C%202022%E2%80%94CDC’s%20first,parts%20of %20gli%20Stati%20Uniti .Google Scholar
28.Tang J , et al. Relazione tra infezioni virali comuni del tratto respiratorio superiore e convulsioni febbrili nei bambini di Suzhou, Cina . J Neurol infantile . 2014Google Scholar
29.29. Van Zeijl , JH , Mullaart , RA , Borm , GF , e Galama , JM ( 2004 ). La ricorrenza di convulsioni febbrili nella stagione respiratoria è associata all’influenza A. Il Giornale di pediatria , 145 ( 6 ), 800 – 805Rif. CrocePubMedGoogle Scholar
30. ↵Espinoza JA , et al. Apprendimento compromesso derivante dall’infezione da virus respiratorio sinciziale . Proc Natl Acad Sci USA . 2013Google Scholar
31. ↵Sapkota , S. , Caruso , E. , Kobau , R. , Radhakrishnan , L. , Jobst , B. , DeVies , J. , Tian , N. , Hogan , RE , Zack , MM , & Pastula , D. M. ( 2022 ). Visite al pronto soccorso correlate a convulsioni o epilessia prima e durante la pandemia di COVID-19 – Stati Uniti, 2019-2021 . MMWR. Rapporto settimanale su morbilità e mortalità , 71 ( 21 ), 703 – 708 . doi: 10.15585/mmwr.mm7121a2 Rif. CroceGoogle Scholar