La vaccinazione con mRNA contro SARS-CoV-2 può comportare stanchezza cronica/disautonomia provvisoriamente definita sindrome da vaccinazione post-acuta contro COVID-19 (PACVS). Abbiamo esplorato gli autoanticorpi recettoriali e l’interleuchina-6 (IL-6) come correlati somatici della PACVS. I marcatori del sangue determinati prima e sei mesi dopo la prima vaccinazione contro SARS-CoV-2 di controlli sani (
N = 89; 71 femmine; età media/mediana: 39/49 anni) sono stati confrontati con i valori corrispondenti di persone affette da PACVS (
N = 191; 159 femmine; età media/mediana: 40/39 anni) che presentavano stanchezza cronica/disautonomia (≥tre sintomi per ≥cinque mesi dopo l’ultima vaccinazione con mRNA contro SARS-CoV-2) non dovuti a infezione da SARS-CoV-2 e/o malattie/farmaci confondenti. La risposta vaccinale normale comprendeva diminuzioni di 11 anticorpi recettoriali (del 25-50%,
p < 0,0001), aumenti di due anticorpi recettoriali (del 15-25%,
p < 0,0001) e IL-6 normale. Nella PACVS, la risposta alla vaccinazione sierologica è apparsa significativamente (
p < 0,0001) alterata, consentendo una discriminazione rispetto allo stato post-vaccinazione normale (sensibilità = 90%,
p < 0,0001) mediante l’aumento degli anticorpi del recettore dell’angiotensina II di tipo 1 (cut-off ≤ 10,7 U/mL, ROC-AUC = 0,824 ± 0,027), la diminuzione degli anticorpi del recettore adrenergico alfa-2B (cut-off ≥ 25,2 U/mL, ROC-AUC = 0,828 ± 0,025) e l’aumento dell’IL-6 (cut-off ≤ 2,3 pg/mL, ROC-AUC = 0,850 ± 0,022). La PACVS è quindi indicata come una sindrome somatica delineata/rilevabile mediante marcatori ematici diagnostici.
Si ritiene che l’insorgenza di sintomi cronici e debilitanti a seguito della vaccinazione contro SARS-CoV-2 costituisca una nuova entità di malattia, per la quale è stato recentemente suggerito il termine sindrome da vaccinazione post-acuta contro COVID-19 (PACVS) [ 1 ]. I sintomi segnalati dalle persone affette da PACVS iniziano subito dopo la vaccinazione contro SARS-CoV-2, continuano in episodi per diversi mesi e compromettono gravemente la qualità della vita. Deve ancora essere condotto un sondaggio sistematico delle caratteristiche cliniche della PACVS. Tuttavia, i casi clinici pubblicati [ 1 ] indicano che la PACVS differisce dai soliti effetti avversi della vaccinazione contro SARS-CoV-2 [ 2 , 3 , 4 , 5 ]. I sintomi più frequentemente riportati nel contesto della PACVS comprendono un benessere compromesso (esaurimento, malessere, stanchezza cronica), disturbi cardiovascolari (intolleranza ortostatica, tachicardia, palpitazioni), neuropatia periferica (disestesia, ipoestesia), disfunzione del sistema nervoso centrale (mancanza di concentrazione, annebbiamento mentale, deficit cognitivi, disturbi del sonno), disfunzione muscolare (mialgia, debolezza, fibrillazioni) e disturbi gastrointestinali (nausea, forti variazioni di peso). In sintesi, la PACVS presenta un fenotipo di disfunzione autonoma acquisita che si sovrappone a varie sindromi disautonomiche multisistemiche consolidate come l’encefalomielite mialgica/sindrome da stanchezza cronica (ME/CFS) [ 6 , 7 ], la sindrome da tachicardia ortostatica posturale (POTS) [ 8 ], la fibromialgia/sindrome da dolore cronico [ 9 ], la neuropatia delle piccole fibre (SFN) [ 10 ] e la sindrome da attivazione dei mastociti (MCAS) [ 11 ]. È interessante notare che sintomi simili a quelli della ME/CFS e della POTS sono stati osservati a seguito di vaccinazioni contro il papillomavirus umano [ 12 , 13 , 14 , 15 , 16 ] e il virus dell’epatite B [ 17 ].
Le sindromi disautonomiche non correlate alla vaccinazione sono frequentemente associate ad alterazioni dell’autoimmunità umorale contro i recettori e i trasmettitori coinvolti nella regolazione autonoma [ 18 , 19 , 20 , 21 ]. L’aumento dei livelli circolanti di questi anticorpi è collegato all’incidenza, alla durata e alla gravità della ME/CFS [ 22 ] e della POTS [ 23 , 24 , 25 ]. La terapia diretta con IgG ha avuto successo nel migliorare i sintomi [ 26 , 27 ]. Aumenti degli anticorpi recettoriali circolanti sono stati osservati anche nel COVID-19 grave [ 28 , 29 , 30 , 31 , 32 ], che presenta in modo simile sintomi simili alla ME/CFS [ 33 ] suscettibili alla terapia diretta con IgG [ 34 ].
Nel complesso, le considerazioni di cui sopra spingono all’ipotesi che gli anticorpi contro gli elementi di regolazione autonomi potrebbero svolgere un ruolo nel PACVS e fungere eventualmente da bersagli terapeutici o marcatori diagnostici. Per affrontare questa ipotesi, abbiamo qui studiato l’impatto della vaccinazione SARS-CoV-2 sugli anticorpi recettoriali noti per essere coinvolti nella POTS [ 20 , 23 , 24 ], ME/CFS [ 18 , 22 , 25 ] e omeostasi immunitaria [ 35 ]. I livelli circolanti di questi anticorpi sono stati misurati prima e sei mesi dopo la vaccinazione in individui sani normali non affetti da PACVS. I livelli normali post-vaccinazione sono stati confrontati con i livelli corrispondenti di una coorte abbinata presumibilmente affetta da PACVS perché presentava sintomi persistenti di disfunzione autonoma cronica grave [ 6 , 7 , 8 , 9 , 10 , 11 ] a seguito della vaccinazione SARS-CoV-2.
2. Materiali e metodi
2.1 Partecipanti allo studio
I partecipanti allo studio che presentavano PACVS a seguito della vaccinazione contro SARS-CoV-2 ( N = 191, N = 32 maschi, età media/mediana = 40/39 anni) sono stati reclutati da gruppi di auto-aiuto utilizzando questionari online. Ai partecipanti è stata diagnosticata ME/CFS, POTS o sindromi correlate/sovrapposte (fibromialgia/sindrome del dolore cronico, SFN e MCAS) e/o hanno mostrato almeno tre sintomi conformi a queste sindromi [ 6 , 7 , 8 , 9 , 10 , 11 ] (dettagli nella Tabella S2 ). Un elenco comparabile di sintomi è stato recentemente osservato nelle sequele croniche di COVID-19 [ 36 ]. I partecipanti sono stati inclusi solo se le diagnosi o i sintomi di cui sopra erano stati confermati da un medico/in un ospedale e persistevano per cinque mesi o più dopo la vaccinazione. Il regime vaccinale precedente al PACVS comprendeva uno (47 casi), due (96 casi) o tre cicli (48 casi) di vaccinazione con Spikevax, Moderna (32 casi) o Comirnaty, Pfizer/BioNTech (159 casi). In 17 casi, la vaccinazione a mRNA che causava il PACVS era preceduta da un ciclo di vaccinazione con un vaccino basato su vettori (dettagli nella Tabella S1 ). I criteri di esclusione comprendevano (i) la comparsa dei sintomi di cui sopra dopo altre vaccinazioni (incluse le vaccinazioni SARS-CoV-2 non a mRNA) e/o dopo un’infezione acuta da SARS-CoV-2, (ii) storie pre-vaccinazione di ME/CFS, POTS o altre malattie o sindromi potenzialmente confondenti, (iii) pre-medicazioni confondenti (dettagli nella Tabella S2 ). Su 1500 individui che hanno fatto domanda di partecipazione allo studio, 1309 sono stati esclusi ( Figura S3 ).
2.2. Controlli
Controlli sani ( N = 89, N = 18 maschi, età media/mediana = 39/49 anni) abbinati per sesso ed età cronologica ( p < 0,001, U-test) sono stati reclutati da uno studio di sorveglianza di dipendenti ospedalieri sani sottoposti a doppia vaccinazione iniziale con vaccino mRNA SARS-CoV-2 (Spikevax, Moderna) [ 37 ]. Campioni di siero accoppiati sono stati ottenuti 48 ore prima della prima vaccinazione e sei mesi dopo la seconda vaccinazione. I candidati di controllo sono stati esclusi quando hanno riportato sintomi della malattia o hanno mostrato prove sierologiche di infiammazione, disfunzione cardiaca o infezione intercorrente da SARS-CoV-2 durante il periodo di sorveglianza di sei mesi dopo la seconda vaccinazione (dettagli nella Tabella S2, Figura S3 ).
2.3. Validazione della vaccinazione e dell’infezione da SARS-CoV-2
La risposta alla vaccinazione contro SARS-CoV-2 nei controlli e nei soggetti dello studio affetti da PACVS è stata confermata in tutti i casi dalla sieroreattività contro la proteina spike S1 (SAB) di SARS-CoV-2. Le infezioni da SARS-CoV-2 completate sono state identificate dalla sieroreattività contro la proteina nucleocapsidica (NAB) di SARS-CoV-2 [ 37 ]. I controlli sono stati esclusi se erano reattivi a NAB o avevano riportato infezioni da SARS-CoV-2 e/o una ricomparsa di COVID-19 nella loro storia clinica. I partecipanti allo studio sono stati esclusi se affetti da infezione da SARS-CoV-2 florida (PCR-positiva).
2.4. Etica
I protocolli di sperimentazione clinica sono stati approvati dal comitato etico locale della Heinrich-Heine University Düsseldorf (numeri di studio 2022-1948 e 2020-1259). L’indagine è conforme ai principi delineati nella Dichiarazione di Helsinki della World’s Medical Association. Prima dell’inclusione nello studio, tutti i partecipanti hanno fornito il consenso informato scritto.
2.5. Misurazioni di laboratorio
Il siero è stato raccolto mediante puntura della vena antecubitale, elaborato secondo procedure accreditate e conservato fino a 6 mesi a -20 °C. Anticorpi contro AT1R (recettore dell’angiotensina II di tipo 1), ETAR (recettore dell’endotelina-1 di tipo A), IL-1-Rb (recettore dell’interleuchina-1 di tipo 2), α1-adr-R (recettore adrenergico alfa-1), α2a-adr-R (recettore adrenergico alfa-2A), α2b-adr-R (recettore adrenergico alfa-2B), α2c-adr-R (recettore adrenergico alfa-2C), β1-adr-R (recettore adrenergico beta-1), β2-adr-R (recettore adrenergico beta-2), M1R–M5R (recettore muscarinico dell’acetilcolina M1–M5), MASR (recettore MAS 1) e ACE-II (enzima di conversione dell’angiotensina 2) sono stati misurati nei sieri utilizzando immunodosaggi disponibili in commercio. (CellTrend GmbH, Luckenwalde, Germania) secondo le istruzioni del produttore. In breve, abbiamo determinato il legame delle IgG alle piastre microtiter rivestite con membrane plasmatiche native di cellule che sovraesprimono i rispettivi recettori. Le IgG legate sono state rilevate dagli anticorpi secondari e dal sistema biotina/streptavidina. Ogni campione di siero è stato determinato in duplicato. I test sono stati calibrati con sieri standard policlonali, producendo valori quantitativi per le IgG specifiche del recettore espresse in unità arbitrarie/mL. Gli anticorpi PanIg contro la proteina spike S1 (SAB) e la proteina nucleocapside (NAB) del SARS-CoV-2 sono stati determinati come precedentemente descritto [ 37 ]. Tutti gli altri test di laboratorio, inclusi quelli per l’interleuchina 6 (IL-6), l’interleuchina 8 (IL-8) e la proteina C-reattiva (CRP), sono stati eseguiti seguendo procedure diagnostiche di laboratorio di routine accreditate. Salvo diversa indicazione, i valori di riferimento hanno seguito le raccomandazioni della Federazione Internazionale di Chimica Clinica (IFCC).
2.6. Metodi statistici
Graph Pad Prism 9 (Graph Pad Software, Inc., San Diego, CA, USA, Graph Pad Prism 9 per Apple Macintosh, rilasciato nel 2020) è stato utilizzato per l’analisi. La distribuzione normale è stata testata utilizzando il test di Shapiro-Wilk. I dati non distribuiti normalmente sono stati presentati sotto forma di valori medi/mediani e intervalli interquartili. Le differenze tra i controlli prima e dopo la vaccinazione sono state analizzate utilizzando il test t per campioni accoppiati (a due code). Le differenze tra i soggetti dello studio e i controlli sono state analizzate utilizzando il test U di Mann-Whitney (a due code). Si è ipotizzato che le correlazioni fossero buone con R di Spearman ≥ 0,7. Per tutti i test, la significatività statistica è stata ipotizzata a p < 0,0001. I dati mancanti sono stati gestiti tramite eliminazione listwise.
3. Risultati
3.1. Impatto della vaccinazione SARS-CoV-2 sugli anticorpi recettoriali nei controlli sani
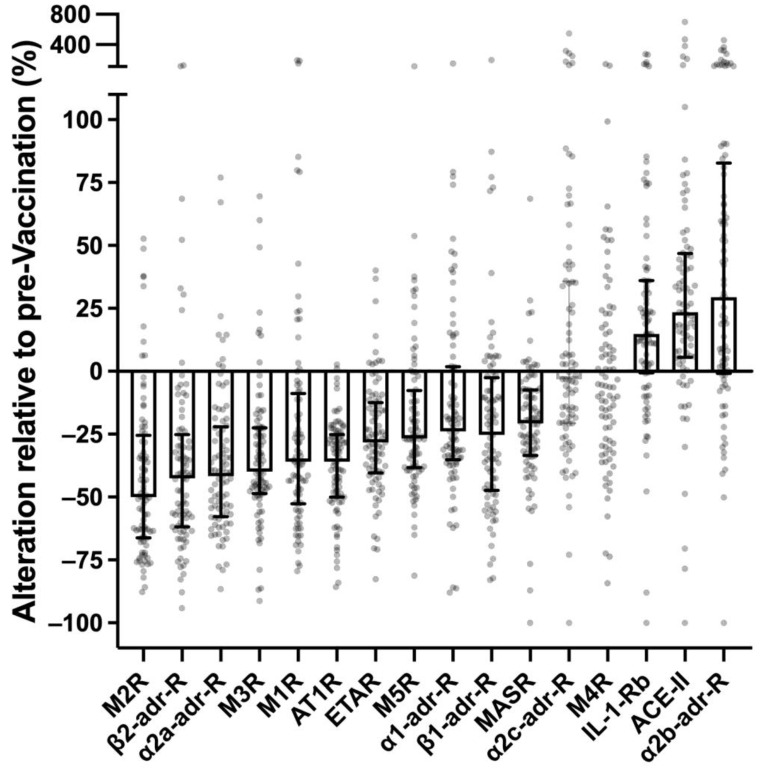
I sieri di controllo sono stati raccolti durante la prima vaccinazione con due cicli del vaccino mRNA Spikevax (Moderna). I campioni sono stati ottenuti 48 ore prima della prima vaccinazione e sei mesi dopo la seconda vaccinazione da 89 individui sani che non hanno riportato reazioni avverse alla vaccinazione persistenti per più di due settimane dopo la vaccinazione completa e non affetti da malattie potenzialmente confondenti. In coppie normali di sieri vaccinati-naïve e post-vaccinazione, i livelli circolanti di IgG specifici per vari recettori (espressi come U/mL) erano in una certa misura covarianti tra loro. I livelli circolanti di anticorpi recettoriali non erano correlati o covarianti, né prima né dopo la vaccinazione, con età cronologica, sesso, IgG totale, pro-peptide natriuretico cerebrale (pBNP) o interleuchina 6 (IL-6), escludendo così questi fattori come potenziali fattori confondenti analitici ( Figura S1 ). Quasi tutti i potenziali anticorpi recettoriali rilevanti per la malattia differivano notevolmente tra i sieri pre e post vaccinazione ( Figura 1 ). Nei sieri post vaccinazione, i livelli di anticorpi contro AT1R, ETAR, M1R, M2R, M3R, M5R, α1-adr-R, α2a-adr-R, β1-adr-R, β2-adr-R e MASR erano notevolmente inferiori (in mediana del 25-50%), mentre i livelli di anticorpi contro IL-1-Rb, ACE-II e α2b-adr-R erano notevolmente superiori (in mediana del 15-25%). Solo due degli anticorpi recettoriali analizzati (α2c-adr-R e M4R) non sono stati influenzati dalla vaccinazione. Le risposte vaccinali degli anticorpi recettoriali circolanti sono state altamente significative ( p < 0,0001, t-test appaiato) e sono persistite per almeno sei mesi dopo l’ultima iniezione di vaccino. Va sottolineato che il marcato impatto della vaccinazione contro SARS-CoV-2 sui livelli circolanti di determinati anticorpi recettoriali è stato osservato in individui sani che non presentavano alcun sintomo di malattia a lungo termine dopo la vaccinazione. Queste alterazioni possono quindi essere considerate una normale reazione (non patologica e non patognomonica) o un adattamento dell’autoimmunità recettoriale umorale alle vaccinazioni con vaccini a mRNA contro SARS-CoV-2.
3.2. Anticorpi GPCR nei controlli post-vaccinazione e nei soggetti affetti da PACVS
Un sottoinsieme di otto degli anticorpi recettoriali analizzati differiva significativamente ( p < 0,0001) tra i sieri post-vaccinazione (6 mesi dopo l’ultima vaccinazione) nella coorte di controllo e i sieri post-vaccinazione (>5 mesi dopo l’ultima vaccinazione) delle persone affette da PACVS ( Figura 2 , confronta le colonne rosse con quelle blu). Sei di questi anticorpi (AT1R, ETAR, M2R, M3R, β2-adr-R, MASR) erano significativamente ( p < 0,0001) più alti nei soggetti PACVS rispetto ai controlli post-vaccinazione. Casualmente, questi sei anticorpi recettoriali mostravano diminuzioni associate alla vaccinazione nei controlli ( Figura 1 ). Di conseguenza, i livelli sierici di questi anticorpi erano più alti nei soggetti PACVS rispetto ai controlli post-vaccinazione ( Figura 2 , confronta le colonne rosse con quelle blu) ma erano simili ai controlli pre-vaccinazione ( Figura 2 , confronta le colonne rosse e verdi). Al contrario, gli anticorpi contro IL-1-Rb e α2b-adr-R erano significativamente ( p < 0,0001) più bassi nei soggetti PACVS rispetto ai controlli (sia prima che dopo la vaccinazione), ma mostravano aumenti associati alla vaccinazione nei controlli ( Figura 1 ). Va notato che le suddette alterazioni associate a PACVS negli anticorpi recettoriali circolanti non erano associate a nessun particolare regime vaccinale elencato nella Tabella S1 .
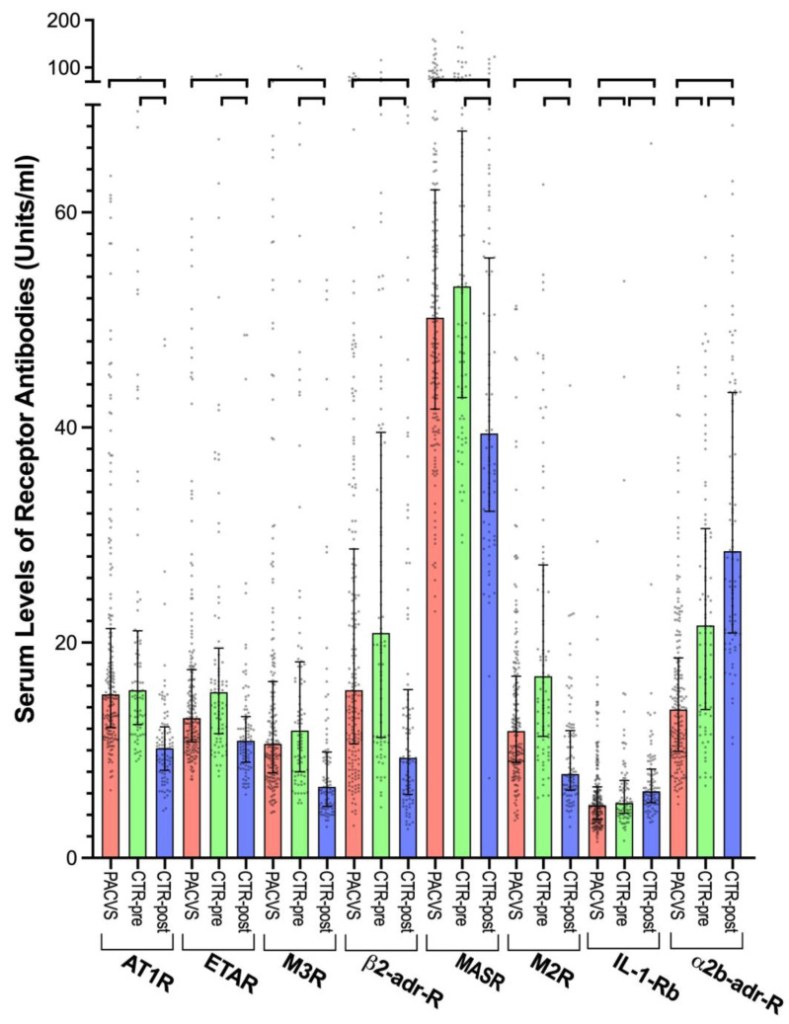
Gli intervalli di confidenza al 95% degli otto anticorpi recettoriali che erano diversi nel PACVS non si sovrapponevano tra i soggetti PACVS e i controlli post-vaccinazione ( Figura 2 e Tabella 1 ), suggerendo che questi anticorpi recettoriali potrebbero agire come biomarcatori che consentono la discriminazione sierologica del PACVS dallo stato normale post-vaccinazione.
Questa ipotesi è stata testata analizzando le caratteristiche del ricevitore-operatore (ROC). Tutti gli otto anticorpi recettoriali candidati hanno mostrato aree significative sotto la curva ROC (Tabella 2 e
Figura S2 ). Le sensibilità per discriminare i soggetti PACVS dai controlli post-vaccinazione al 95% di specificità (sulla base dei limiti di confidenza dei controlli post-vaccinazione) variavano dal 40 al 90% (
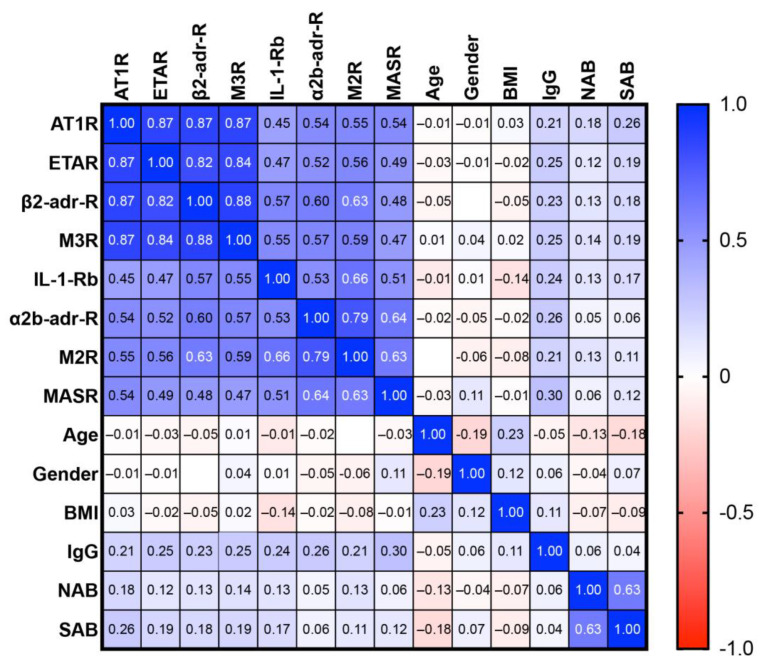
Tabella 2 ), il che indica che non tutti gli anticorpi recettoriali avevano poteri predittivi simili. Inoltre, l’analisi di correlazione incrociata degli anticorpi recettoriali di cui sopra (Figura 3 ) ha rivelato due cluster di covarianza significativa (Spearman’s R ≥ 0,7, p < 0,0001), uno costituito da AT1R, ETAR, M3R, β2-adr-R e l’altro costituito da α2b-adr-R e M2R.
Da notare che gli anticorpi recettoriali rilevanti per PACVS non erano correlati (Spearman’s R < 0,7, p > 0,1) con IgG totale, sierologia COVID (SAB, NAB), sesso, età o indice di massa corporea (BMI), escludendo questi fattori come fattori confondenti (Figura 3 ). È stata ottenuta una discriminazione ottimale dei soggetti PACVS dai controlli post-vaccinazione sulla base di aumenti di AT1R e MASR e diminuzioni di IL-1-Rb e α2b-adr-R rispetto ai limiti di confidenza del 95% dei controlli sani post-vaccinazione. In queste condizioni, AT1R e α2b-adr-R hanno mostrato una buona sensibilità (rispettivamente 90,1 e 89,5%) e MASR e IL-1-Rb hanno mostrato una sensibilità moderata (rispettivamente 71,8 e 66,5%) per PACVS (Tabella 2 ).
Tabella 1.
Anticorpi recettoriali prima/dopo la vaccinazione e nella PACVS.
| Mediana 1 | Perc. al 25%. | Perc. al 75%. | ∆ rispetto al PACVS ( p , test U) | |
|---|---|---|---|---|
| AT1R | ||||
| PACVS 2 ( n = 191) | 15.2 | 12.1 | 21.3 | – |
| Controllo prima 3 ( n = 89) | 15.6 | 12.4 | 21.1 | NS 5 |
| Post di controllo 4 ( n = 89) | 10.4 | 8.1 | 12.4 | <0,0001 |
| ETAR | ||||
| PACVS ( n = 191) | 13.5 | 10.8 | 18.5 | – |
| Controllo pre ( n = 99) | 15.4 | 11.6 | 19.5 | N.S. |
| Post di controllo ( n = 89) | 11.0 | 8.8 | 13.8 | 0,0001 |
| IL-1-Rb | ||||
| PACVS ( n = 191) | 4.9 | 3.8 | 6.9 | – |
| Controllo pre ( n = 89) | 5.1 | 4.2 | 7.2 | N.S. |
| Post di controllo ( n = 89) | 6.2 | 5.3 | 8.2 | <0,0001 |
| M3R | ||||
| PACVS ( n = 191) | 10.6 | 7.9 | 16.4 | – |
| Controllo pre ( n = 89) | 11.9 | 8.0 | 18.2 | N.S. |
| Post di controllo ( n = 89) | 6.6 | 4.8 | 9.2 | <0,0001 |
| β2-adr-R | ||||
| PACVS (n = 191) | 12.8 | 8.9 | 16.6 | – |
| Controllo pre (n = 89) | 20.9 | 11.2 | 39.6 | N.S. |
| Post di controllo ( n = 89) | 9.3 | 5.8 | 14.4 | <0,0001 |
| MASR | ||||
| PACVS ( n = 191) | 50.2 | 41.7 | 62.1 | – |
| Controllo pre ( n = 89) | 53.1 | 42.8 | 67.6 | N.S. |
| Post di controllo ( n = 89) | 39.2 | 31.7 | 45.7 | <0,0001 |
| M2R | ||||
| PACVS ( n = 191) | 11.8 | 8.9 | 16.9 | – |
| Controllo pre ( n = 89) | 16.9 | 11.3 | 27.2 | <0,0001 |
| Post di controllo ( n = 89) | 7.7 | 6.2 | 11.7 | <0,0001 |
| α2b-adr-R | ||||
| PACVS ( n = 191) | 13.8 | 9.9 | 18.6 | – |
| Controllo pre ( n = 89) | 21.6 | 13.8 | 30.6 | <0,0001 |
| Post di controllo ( n = 89) | 27.9 | 20.9 | 43.2 | <0,0001 |
1 Unità/mL,
2 manifestazione dei sintomi della malattia per sei o più mesi dopo l’ultima vaccinazione con vaccino mRNA,
3 prima della prima vaccinazione con Spikevax (Moderna),
4 sei mesi dopo la seconda vaccinazione con Spikevax (Moderna),
5 non significativo.
Tabella 2.
Discriminazione del PACVS dai controlli post-vaccinazione in base agli anticorpi recettoriali e all’IL-6.
| ROC (AUC ± SE) | ROC ( p ) | Valore limite (U/mL) 1 | Sensibilità (%) 2 | |
|---|---|---|---|---|
| AT1R | 0,824 ± 0,027 | <0,0001 | ≤10,7 | 89.7 |
| ETAR | 0,681 ± 0,035 | <0,0001 | ≤11,5 | 64,9 |
| M3R | 0,741 ± 0,034 | <0,0001 | ≤12,4 | 40.3 |
| β2-adr-R | 0,681 ± 0,036 | <0,0001 | ≤11,6 | 66,5 |
| α2b-adr-R | 0,828 ± 0,025 | <0,0001 | ≥25,2 | 90.3 |
| M2R | 0,703 ± 0,034 | <0,0001 | ≥14,2 | 64,4 |
| MASR | 0,675 ± 0,037 | <0,0001 | ≤44.0 | 72.3 |
| IL-1-Rb | 0,913 ± 0,019 | <0,0001 | ≥5,8 | 66,5 |
| IL-6 | 0,850 ± 0,022 | <0,0001 | ≥2,3 | 82.0 |
1 Derivato dai limiti degli intervalli di confidenza al 95% dei controlli post-vaccinazione, 2 Al 95% di specificità rispetto ai controlli post-vaccinazione.
3.3. Discriminazione del PACVS dai controlli post-vaccinazione basati sulle interleuchine
Abbiamo confrontato i soggetti PACVS e i controlli post-vaccinazione utilizzando un pannello di base di marcatori di laboratorio potenzialmente rilevanti che comprende IgG totali (IgG), sierologia SARS-CoV-2 (SAB, NAB), marcatori cardiaci (proBNP, Troponina T) e marcatori di infiammazione (IL-6 e proteina C-reattiva, PCR). Di questi parametri, solo IL-6 è stato identificato come un biomarcatore potenzialmente discriminante di PACVS ( Tabella 2 e Figura 4 ). I livelli di IL-6 sono aumentati al di sopra del livello di riferimento nella maggior parte dei soggetti PACVS ed erano significativamente ( p < 0,0001) più alti rispetto ai controlli post-vaccinazione ( Figura 4 A). Le curve ROC hanno indicato una ragionevole discriminazione dei soggetti PACVS dai controlli post-vaccinazione in base a IL-6 (AUC = 0,85, Figura 4 C). È interessante notare che la PCR era simile nei soggetti PACVS e nei controlli ( Figura 4 B), mentre nei PACVS, i livelli aumentati di IL-6 erano linearmente correlati con aumenti ancora più pronunciati dell’interleuchina 8 (IL-8) ( Figura 4 D). IL-6 e IL-8 sono stati quindi identificati come biomarcatori aggiuntivi del PACVS.
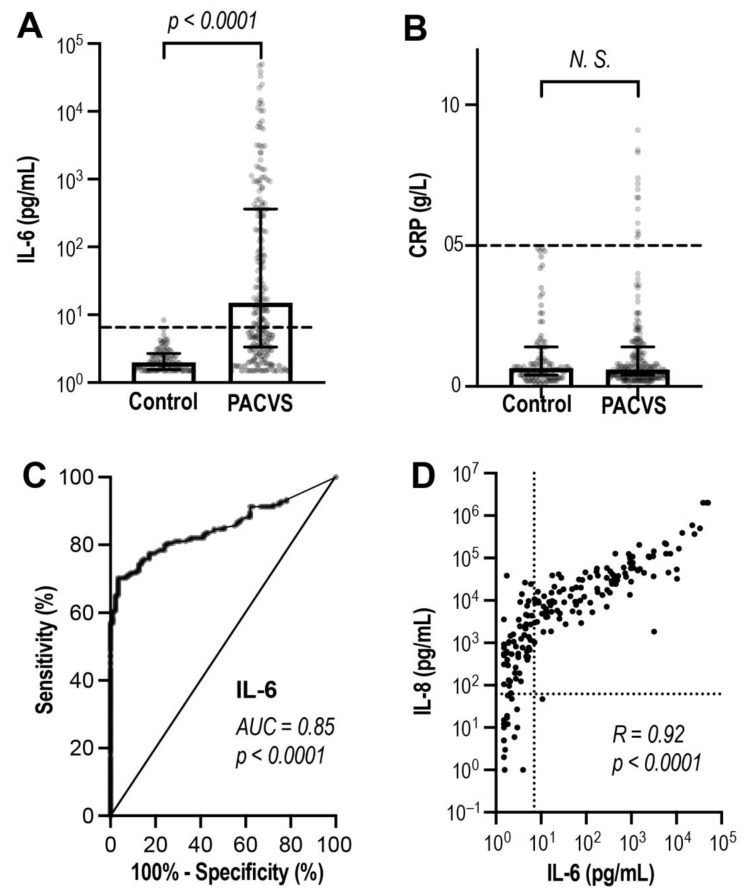
N = 88) e nei soggetti PACVS (PACVS, N = 191) utilizzando il test U. (C ) I valori di IL-6 sono stati sottoposti ad analisi ROC (identità indicata dalla linea continua).
(D ) Analisi di correlazione di Spearman dei valori di IL-6 e IL-8 dai soggetti PACVS. Riquadri: mediane; barre di errore: intervalli interquartili; parentesi: risultati del test U (NS: non significativo). Linee tratteggiate: limiti di confidenza al 99% dei valori di riferimento corretti per età e sesso in (C ).
3.4. Esclusione dell’infezione da SARS-CoV-2/riconvalescenza da COVID-19 come fattore confondente del PACVS
Le persone affette da infezioni floride da SARS-CoV-2 sono state escluse dallo studio. Tuttavia, un sottogruppo di soggetti affetti da PACVS inclusi (76/191) ha mostrato reattività a NAB. Un totale di 52 di questi soggetti ha riportato infezioni da SARS-CoV-2 o ri-convalescenza da COVID-19 nelle loro storie cliniche. Gli altri 24 partecipanti NAB-positivi sembravano aver contratto l’infezione da SARS-CoV-2 senza notarlo. Al contrario, i controlli post-vaccinazione sono stati selezionati in base all’assenza di reattività a NAB e alla mancata segnalazione di infezione da SARS-CoV-2 durante il periodo di monitoraggio. Per escludere la reattività a NAB come possibile fattore confondente dei biomarcatori diagnostici di PACVS, abbiamo confrontato i biomarcatori candidati di PACVS (elencati nella Tabella 2 ) tra soggetti PACVS NAB-positivi ( N = 76) e NAB-negativi ( N = 115). Tutti i biomarcatori PACVS candidati hanno mostrato valori leggermente più alti nei soggetti PACVS NAB-positivi rispetto ai soggetti PACVS NAB-negativi ( Tabella 3 , prime tre colonne da sinistra). La maggior parte di queste differenze erano piccole (dimensione dell’effetto mediano < 10%) e insignificanti ( p > 0,5, test U). Solo AT1R e M3R hanno mostrato aumenti più pronunciati (dimensioni dell’effetto mediano 12,8 e 20,2%, rispettivamente) e marginalmente significativi ( p ≤ 0,05, test U) nei soggetti PACVS NAB-positivi rispetto ai soggetti PACVS NAB-negativi. Tuttavia, le differenze corrispondenti in AT1R e M3R tra soggetti PACVS NAB-negativi e controlli post-vaccinazione NAB-negativi erano molto maggiori (dimensioni dell’effetto mediano > 40%) e di maggiore significatività ( p < 0,0001) ( Tabella 3 , confronta colonne 4 e 5). Pertanto, ipotizziamo che l’effetto confondente delle infezioni da SARS-CoV-2 sulla diagnosi di PACVS sia molto limitato e trascurabile.
Tabella 3.
Impatto della passata infezione da SARS-CoV-2 sui marcatori candidati del PACVS.
| PACVS ± COVID 1 | PACVS senza COVID vs. post-vaccinazione CTR 2 | |||
|---|---|---|---|---|
| Dimensione dell’effetto mediano 3 (%) | Significato ( p ) 4 | Dimensione dell’effetto mediano 3 (%) | Significato ( p ) 4 | |
| AT1R | +12.8 | 0,01 | +43 | <0,0001 |
| ETAR | +7.9 | 0,11 | ||
| β2-adr-R | +7.2 | 0,07 | ||
| M3R | +20.3 | 0,05 | +44.4 | <0,0001 |
| IL-1-Rb | +6.3 | 0,08 | ||
| α2b-adr-R | +4.8 | 0,50 | ||
| M2R | +9.5 | 0,06 | ||
| MASR | +4.1 | 0,40 | ||
| IL-6 | -1,3 | 0,33 | ||
4. Discussione
4.1. Risultati salienti
Presentiamo una serie di osservazioni potenzialmente rilevanti per la comprensione e la diagnosi della PACVS, una sindrome disautonomica associata e possibilmente innescata dalla vaccinazione con mRNA contro SARS-CoV-2 [ 1 ]:
- Nei soggetti sani non affetti da PACVS, il repertorio di anticorpi recettoriali coinvolti nella regolazione cardiovascolare e nell’omeostasi immunitaria subisce un aggiustamento a lungo termine a seguito della vaccinazione con mRNA contro SARS-CoV-2.
- La regolazione di cui sopra sembra attenuata, assente o addirittura invertita nei soggetti che presentano fenotipi clinici di PACVS dopo la vaccinazione con mRNA contro SARS-CoV-2.
- Le persone affette da PACVS possono essere distinte dagli individui sottoposti a vaccinazione mRNA contro SARS-CoV-2 senza sviluppare PACVS sulla base dei livelli sierici di IL-6/IL-8 e degli anticorpi contro AT1R e α2b-adr-R.
4.2 Limitazioni
- Il nostro studio è limitato ai vaccini mRNA SARS-CoV-2, per i quali avevamo una coorte di controllo appropriata. Resta da verificare se i nostri risultati si applichino alle sequele croniche conseguenti ad altri tipi di vaccinazioni SARS-CoV-2, o anche alle vaccinazioni in generale.
- Il fenotipo clinico PACVS qui studiato si basa su un lungo elenco di sintomi. È eterogeneo e probabilmente comprende più di un’entità clinica. Inoltre, la selezione dei casi PACVS studiati è distorta dall’esclusione di 71 candidati con comorbilità o farmaci potenzialmente confondenti che potrebbero comunque soffrire di PACVS.
- La coorte PACVS è stata reclutata cinque o più mesi dopo la vaccinazione. Non è stato possibile ottenere sieri pre-vaccinazione corrispondenti da queste stesse persone. Di conseguenza, le alterazioni sierologiche associate alla vaccinazione nella coorte PACVS non potevano essere determinate intraindividualmente, ma dovevano essere giudicate tramite il confronto con una coorte di controllo post-vaccinazione corrispondente.
- Gli anticorpi recettoriali sono stati determinati dal legame IgG ai recettori nativi. Noi e altri abbiamo precedentemente dimostrato che tali anticorpi possono modulare la funzione recettoriale in diversi modi [ 38 ]; tuttavia, le proprietà funzionali degli anticorpi recettoriali non sono state valutate direttamente in questo studio.
- La nostra osservazione è stata limitata a un periodo di 5-6 mesi dopo la vaccinazione. Non sappiamo per quanto tempo gli effetti osservati durino oltre questo periodo.
4.3. La risposta fisiologica degli anticorpi recettoriali alla vaccinazione con mRNA SARS-CoV-2
Nelle persone non affette da PACVS, solo 2 delle 16 specie di anticorpi recettoriali testate sono rimaste inalterate dopo la vaccinazione con mRNA SARS-CoV-2, mentre 11 sono diminuite e tre sono aumentate per un periodo prolungato. Questa risposta robusta e duratura era prevalente in una coorte sana; pertanto, rappresenta probabilmente una risposta vaccinale fisiologica del repertorio di anticorpi recettoriali comprendente due caratteristiche distinte:
- Downregulation di un cluster di anticorpi recettoriali che prendono di mira il sistema renina-angiotensina-aldosterone e altri componenti della regolazione cardiovascolare. Per inciso, alcuni di questi anticorpi recettoriali aumentano frequentemente nella POTS [ 20 , 23 , 24 ], ME/CFS [ 18 , 22 , 25 ], COVID-19 grave [ 28 , 29 , 30 , 31 , 32 ], insufficienza cardiaca cronica [ 39 , 40 ] e rigetto dell’allotrapianto [ 41 ]. Il candidato più distintivo di questo cluster è l’anticorpo AT1R.
- Due anticorpi recettoriali sono stati sovraregolati. Si ritiene che uno di questi, l’anticorpo IL-1-Rb, svolga un ruolo nell’omeostasi immunitaria [ 35 ] e abbia un effetto protettivo contro alcune malattie reumatiche [ 42 ]. Il recettore α2b-adr-R, d’altra parte, svolge un ruolo nella trombogenesi e la sua inibizione da parte di antagonisti di piccole molecole contrasta l’aggregazione piastrinica indotta da adenosina difosfato, epinefrina o acido arachidonico in campioni di sangue di individui sani [ 43 ].
4.4. Presunto ruolo patogeno dell’adattamento dell’anticorpo del recettore smussato nella PACVS
I livelli di anticorpi recettoriali nei sieri di persone affette da PACVS erano diversi dallo stato post-vaccinazione ma simili allo stato pre-vaccinazione di persone non affette da PACVS. Pertanto, la PACVS è potenzialmente associata a una mancanza o attenuazione dell’adattamento fisiologico del repertorio di anticorpi recettoriali a seguito della vaccinazione con mRNA SARS-CoV-2. Questa conclusione non poteva essere corroborata da prove inconfutabili perché i sieri vaccinati-naïve non potevano essere ottenuti post festum dalle persone affette da PACVS.
Molti degli anticorpi recettoriali sottoregolati nelle persone sane ed elevati nei soggetti PACVS sono stati precedentemente implicati come marcatori di malattia, fattori di rischio, patogeni o persino bersagli terapeutici nella POTS [ 20 , 23 , 24 ], ME/CFS [ 18 , 22 , 25 ], COVID-19 grave [ 28 , 29 , 30 , 31 , 32 ], insufficienza cardiaca cronica [ 39 , 40 ], rigetto di allotrapianto [ 41 ], malattie reumatiche [ 42 ] e varie altre sindromi e malattie [ 44 ]. È plausibile supporre che la sottoregolazione di questi anticorpi recettoriali associata alla vaccinazione protegga eventualmente dalle malattie e sindromi di cui sopra, mentre la loro mancanza o attenuazione le imita, almeno in parte.
Al contrario, l’anticorpo IL-1Rb è sovraregolato negli individui sani dopo la vaccinazione, ma è diminuito nei soggetti PACVS. Ha come bersaglio un recettore coinvolto nel rilascio di citochine [ 35 , 42 ]. La sovraregolazione di questo anticorpo potrebbe quindi svolgere un ruolo nella limitazione delle risposte infiammatorie alla vaccinazione con mRNA SARS-CoV-2. La sua mancanza potrebbe contribuire alla persistenza dell’aumento di IL-6, che distingue la coorte PACVS dallo stato normale post-vaccinazione. È interessante notare che la sovraregolazione di IL-6 associata a PACVS è correlata a una sovraregolazione ancora più pronunciata di IL-8, che è stata osservata anche nella ME/CFS post-COVID-19 [ 33 ].
La sovraregolazione associata alla vaccinazione degli anticorpi α2b-adr-R potrebbe avere analogamente uno scopo protettivo. È concepibile che questi anticorpi interferiscano con la stimolazione del recettore α2b-adr sulle piastrine tramite adenosina difosfato, epinefrina o acido arachidonico, neutralizzando così la sua funzione protrombotica [ 43 ]. In tal senso, la sovraregolazione dell’anticorpo α2b-adr-R a seguito della vaccinazione contro SARS-CoV-2 potrebbe essere un meccanismo di compensazione dello stimolo protrombotico della vaccinazione [ 4 ]. La mancanza di tale meccanismo compensatorio nella PACVS sarebbe potenziata da aumenti concomitanti di IL-6 e IL-8 che promuovono la trombosi tramite altre vie [ 45 ]. Funzioni protettive simili sono state descritte per gli anticorpi del recettore β-adrenergico nella cardiomiopatia pediatrica [ 46 ] e nell’asma allergico [ 47 ].
In sintesi, queste considerazioni danno origine all’interessante speculazione che il PACVS potrebbe derivare dall’incapacità di rispondere alla vaccinazione mRNA SARS-CoV-2 con aggiustamenti protettivi del repertorio di anticorpi recettoriali che comportano un mimetismo fenotipico di sindromi associate a corrispondenti aberrazioni di anticorpi recettoriali, ad esempio POTS, ME/CFS e alcune malattie reumatiche [ 42 ] e la perdita di funzioni protettive degli anticorpi recettoriali. Va notato che il PACVS, come presentato dai partecipanti a questo studio, appare distinto da vari fenomeni autoimmuni acuti casisticamente riportati nel contesto della vaccinazione SARS-CoV-2 [ 5 ].
4.5. La firma del marcatore sanguigno del PACVS
Indipendentemente dal presunto ruolo patogenetico degli anticorpi recettoriali nel PACVS, una combinazione di due anticorpi recettoriali indice (AT1R e α2b-adr-R) in combinazione con IL-6 consente la discriminazione del PACVS dallo stato post-vaccinazione normale con una sensibilità e specificità cumulative fino al 90%. Tuttavia, aumenti degli anticorpi IL-6 [ 48 ], IL-8 [ 33 ] e AT1R [ 28 ] sono stati osservati anche nel COVID-19 lungo e nella ME/CFS post-COVID-19. Pertanto, saranno necessari ulteriori studi per scoprire se la firma del marcatore del sangue suggerita distingue in modo simile il PACVS dalle forme non correlate alla vaccinazione di malattie potenzialmente confondenti come il COVID-19 lungo e la ME/CFS, che sono state escluse da questo studio. È concepibile che il potere discriminante della diagnosi del PACVS possa essere migliorato aggiungendo ulteriori marcatori del sangue indipendenti identificati in questo studio, in particolare anticorpi contro MASR e IL-1-Rb.
5. Conclusioni
La frazione di persone vaccinate che soffrono di PACVS è sconosciuta. Le stime attuali presumono un’incidenza dello 0,02%, pari a 40.000 persone colpite nella sola Germania. Questi pazienti attualmente non vengono trattati in modo appropriato per diversi motivi: (i) Il numero di casi non segnalati è elevato perché non sono stabiliti criteri diagnostici. Non è nemmeno generalmente accettato che la sindrome esista. (ii) Il numero di casi falsi positivi è elevato perché la PACVS è simile a varie malattie e sindromi non correlate alla vaccinazione. Inoltre, le sequele di infezioni da SARS-CoV-2 non rilevate potrebbero essere erroneamente attribuite alla vaccinazione contro SARS-CoV-2. A causa di questi fattori, la PACVS attualmente non viene/viene raramente diagnosticata in termini di malattia somatica. Invece, i casi di PACVS tendono a essere classificati come psicosomatici o scartati come irrilevanti o immaginari.
Il nostro studio potrebbe contribuire a migliorare questa situazione insoddisfacente in due modi: forniamo prove del PACVS come malattia somatica collegando un fenotipo clinico con specifiche alterazioni patognomoniche nei marcatori sierologici; quindi, suggeriamo criteri diagnostici per una discriminazione oggettiva del PACVS dalla condizione di salute post-vaccinazione. Questi criteri potrebbero non essere sufficientemente specifici per separare il PACVS da tutte le malattie confondenti o per la diagnosi del PACVS nell’assistenza sanitaria clinica. Tuttavia, la diagnostica di laboratorio proposta può fungere da rigoroso criterio di esclusione, consentendo ai futuri studi sul PACVS di concentrarsi sui casi probabili.
È stata posta grande attenzione nell’escludere possibili fattori confondenti da questo studio ( Figura S3 ). Tuttavia, l’inclusione come definita dai sintomi elencati nella Tabella S2 è stata meno mirata. Di conseguenza, il fenotipo PACVS emergente dal presente studio è eterogeneo e probabilmente comprende più di un’entità clinica. Riteniamo che un obiettivo degli studi futuri dovrebbe essere quello di tracciare un quadro clinico più chiaro e differenziato del PACVS e di utilizzare la firma del biomarcatore suggerita per la stratificazione dei pazienti in un contesto di studio prospettico.