Uno studio di coorte su larga scala basato sulla popolazione
Hong Jin Kim1,2,†, Jee Hyun Suh3,†, Kim Min-Ho4, Myeong Geun Choi5e Eun Mi Chun5,*
Gli studi attuali sugli eventi avversi correlati al vaccino COVID-19 si sono
concentrati prevalentemente su effetti collaterali gravi e potenzialmente letali. Tuttavia, numerosi eventi
avversi (AE) meno gravi ma comuni rimangono sottostimati e non sufficientemente studiati nonostante il loro potenziale impatto.
Metodi:
Questo studio di coorte basato sulla popolazione ha esaminato il tasso di
incidenza cumulativa (cIR) e il rischio di eventi avversi ad ampio spettro di interesse speciale (AESI) basati sulla risposta immunitaria, tra cui problemi ginecologici, dermatologici, oftalmologici, otologici e dentali, a seguito della vaccinazione contro il COVID-19.
Risultati
Tra 4.203.887 individui a Seoul, Corea del Sud,
l’analisi finale ha incluso 1.458.557 soggetti vaccinati e 289.579 soggetti non vaccinati dopo l’esclusione delle malattie sottostanti.
Il cIR delle AESI per tre mesi è stato significativamente più alto nei soggetti
vaccinati rispetto ai soggetti non vaccinati, ad eccezione dell’endometriosi.
La vaccinazione ha aumentato significativamente i rischi di tutte le AESI, ad eccezione della disabilità visiva. Il rischio di alopecia ha
mostrato gli HR più elevati (HR [95% CI] = 2,40 [1,90–3,03]) tra le AESI dopo la vaccinazione COVID-19.
Tra i soggetti vaccinati, la vaccinazione eterologa è stata associata all’aumento del rischio della maggior parte delle AESI.
Conclusioni:
I nostri risultati suggeriscono che i medici dovrebbero riconoscere e monitorare attentamente i vari eventi avversi correlati al vaccino contro il COVID-19, a causa del loro impatto sconosciuto, anche se al momento potrebbero non essere gravi.
La malattia da coronavirus 2019 (COVID-19), in quanto sfida globale per la salute e i problemi socioeconomici, ha dimostrato un successivo aumento della morbilità e della mortalità nelle fasi iniziali della pandemia rispetto ad altre infezioni virali [1].
Con il rapido sviluppo del vaccini
in risposta alla pandemia senza precedenti di COVID-19, si è contribuito alla riduzione dei tassi di gravità e mortalità. Successivamente, diversi tipi di vaccini dopo l’approvazione del vaccino AZD1222 sono stati rilasciati per prevenire l’infezione da COVID-19 [2–5].
Tuttavia, è stata osservata un’ampia gamma di eventi avversi (EA) di interesse speciale (AESI), non precedentemente segnalati nei vaccini convenzionali, dopo la vaccinazione [6–9]. Lee et al. hanno studiato gli eventi avversi associati ai vaccini COVID-19 tra il 28 febbraio e il 21 agosto 2021 [10]. In questo studio, l’incidenza degli eventi avversi causati dalla vaccinazione contro il COVID-19 variava in base all’età, al sesso e all’ordine delle dosi [10]. In particolare, sono stati osservati vari AE in tutti i tipi di vaccini anti-COVID-19 [10].
Come ogni paese ha fatto, la Corea del Sud ha avviato il programma di vaccinazione contro il COVID-19 presso le strutture di assistenza e successivamente ha ampliato la sua copertura per comprendere l’intera popolazione della nazione. Circa l’80% della popolazione in Corea del Sud è stata vaccinata entro un anno, il che ha contribuito a una significativa diminuzione dell’infezione da COVID-19 [9]. Nel frattempo, ci sono sempre più prove che molte popolazioni vaccinate potrebbero sperimentare diverse complicazioni inaspettate, come gli eventi avversi (AE), in base alle risposte immunitarie [6–8,10,11]. Si ritiene che molti eventi avversi post-vaccinazione derivino da una risposta immunitaria caratterizzata da una tempesta di citochine infiammatorie che causa danni irreversibili ai sistemi cardiovascolare, cerebrovascolare e respiratorio [12,13].
Gran parte della letteratura attuale sugli eventi avversi successivi alla vaccinazione contro il COVID-19 si è concentrata su eventi avversi gravi, come le complicazioni cardiovascolari, che limitano le attività quotidiane di oltre il 50%, richiedono l’ospedalizzazione o pongono rischi potenzialmente letali [10]. Dato questo background, il nostro interesse particolare è rivolto agli eventi avversi non gravi ma comuni, che devono ancora essere segnalati in modo completo [11,14–20]. Sulla base delle reazioni infiammatorie basate sul sistema immunitario in seguito alla vaccinazione contro il COVID-19, abbiamo studiato 13 AE ad ampio spettro che sono potenzialmente collegati ai meccanismi immunomediati della vaccinazione contro il COVID-19. Pertanto, questo studio mira a valutare gli AE dopo la vaccinazione contro il COVID-19 dal database del National Health Insurance Service (NHIS) di Seoul, Corea del Sud.
2. Materiali e metodi
2.1. Fonte dei dati
Questo dal database coreano NHIS il 1° gennaio 2021 ha estratto casualmente il 50% degli individui residenti a Seoul, Corea del Sud, come campione rappresentativo. Abbiamo selezionato casualmente il 50% dei residenti residenti a Seoul al 1° gennaio 2021. La Classificazione internazionale delle malattie,
10a revisione (ICD-10), è stata adottata dall’NHIS per classificare le diagnosi di malattia. I dati includevano la diagnosi primaria, la diagnosi secondaria e le date delle visite ospedaliere. Questo studio di coorte basato sulla popolazione è stato condotto utilizzando le linee guida Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) [21].
2.2. Popolazione dello studio
Un totale di 4.348.412 individui residenti a Seul, che costituiscono il 50% della popolazione, sono stati inclusi e studiati al 1° gennaio 2021. Gli individui di età inferiore ai 20 anni sono stati esclusi, lasciando 4.203.887 individui per l’analisi. In questo studio, solo gli individui che avevano ricevuto due dosi di vaccino COVID-19 sono stati inclusi nel gruppo vaccinato. In questo studio di coorte, la data indice, che è la data in cui gli individui hanno iniziato a partecipare allo studio, è stata impostata in modo diverso per i gruppi vaccinati e non vaccinati. Per il gruppo vaccinato, la data indice è stata impostata come data della seconda dose di vaccino somministrata prima del 1° ottobre 2021. D’altro canto, per il gruppo non vaccinato, la data indice è stata impostata come 1° ottobre 2021 per garantire almeno un periodo di osservazione di 3 mesi. Il gruppo vaccinato includeva 3.839.014 individui, mentre il gruppo non vaccinato includeva 364.873 individui. Sono stati esclusi gli individui che hanno ricevuto una dose di vaccino prima del 1° gennaio 2021 e che non hanno ricevuto una seconda dose tra il 1° gennaio 2021 e il 1° ottobre 2021.
Il gruppo vaccinato comprendeva 2.154.389 individui, mentre il gruppo non vaccinato comprendeva 350.953 individui.
Gli eventi avversi ad ampio spettro che non sono gravi ma comuni includono problemi ginecologici (endometriosi [N80] e disturbi mestruali [N92; polimenorragia, menorragia, durata anomala del ciclo, oligomenorrea e amenorrea]), ematologici (lividi [D69] limitati a zone non dolenti e di colore giallo, in particolare sulle estremità), dermatologici (herpes zoster [B02], alopecia [L63] e verruche [B07]), oftalmologici (deficit visivo [H54] e glaucoma [H40, H42]), otologici (tinnito [H93.1], malattie dell’orecchio interno [H81-83], dell’orecchio medio [H65-67] e dell’orecchio esterno [H90-94]) e problemi dentali (malattia parodontale [K05]) come riportato dal Vaccine Adverse Event Reporting Center. Sono stati tracciati i dati diagnostici per un anno prima della data indice. Sono stati esclusi dallo studio gli individui con una qualsiasi malattia target come diagnosi primaria o secondaria durante questo periodo. L’occorrenza della malattia target è stata definita come la ricezione di una diagnosi primaria della malattia dal giorno successivo alla data indice.
2.3. Misurazioni dei risultati
La misura dell’esito primario era il tasso di incidenza cumulativa (cIR) degli AE per
10.000 popolazione tra i soggetti vaccinati e non vaccinati. I cIR degli AE sono stati misurati a una settimana, due settimane, un mese e tre mesi. Per monitorare l’occorrenza degli AE target fino a tre mesi dopo la vaccinazione, abbiamo tracciato diversi punti temporali: una settimana e due settimane per valutare le risposte immediate e acute, un mese per catturare gli eventi a insorgenza ritardata e tre mesi come follow-up finale in questo studio. Le misure di esito secondarie erano gli odd ratio (OR) e gli hazard ratio (HR) degli AE. Inoltre, sono state condotte analisi di sottogruppi basate anche sul genere, sul numero di dosi di vaccino COVID-19, sul tipo di vaccino (vaccino a mRNA [vaccinazione utilizzando solo piattaforme di vaccini basate su mRNA], vaccino a cDNA [vaccinazione utilizzando solo piattaforme di vaccini basate su cDNA] e vaccinazione eterologa [quando la prima e la seconda dose sono state somministrate utilizzando piattaforme di vaccini diverse]), sul livello di assicurazione sanitaria, sulla presenza di diabete mellito (DM), ipertensione (HTN), iperlipidemia e broncopneumopatia cronica ostruttiva (BPCO).
Età, sesso, livello assicurativo, indice di comorbilità di Charlson (CCI), presenza di DM, ipertensione, iperlipidemia e BPCO e precedente storia di infezione da COVID-19 sono stati estratti utilizzando i loro codici ICD-10, suggeriti da Sundararajan et al. La presenza di malattie comorbide (vale a dire DM, ipertensione, iperlipidemia e BPCO), gli elementi nel CCI e la precedente storia di infezione da COVID-19 sono stati determinati come diagnosi primaria o secondaria 2 o più volte entro 1 anno prima della data indice [22]. Il premio NHI è stato utilizzato come misura proxy del reddito perché è proporzionale al reddito mensile, inclusi guadagni e plusvalenze. I quantili di reddito degli individui iscritti sono stati categorizzati in tre gruppi (gruppi a basso, medio e alto reddito negli iscritti all’assistenza medica e i percentili 0-33, 34-66 e 67-100 degli iscritti NHI).
2.4. Analisi statistica
L’analisi statistica è stata eseguita utilizzando la SAS Enterprise Guide (versione 8.3., SAS Institute, Cary, NC, USA). La normalità della distribuzione dei dati è stata valutata utilizzando il test di Kolmogorov-Smirnov. Le caratteristiche basali dei pazienti e le comorbilità sono state riportate come medie±deviazione standard per variabili continue e come frequenze (percentuali, %) per variabili categoriali. Per confronti di gruppo, Student’sT-test è stato utilizzato per le variabili continue, mentre le variabili categoriali sono state analizzate utilizzando il test del chi-quadrato o il test esatto di Fisher, quando appropriato. Anche gli eventi avversi immunomediati associati alla vaccinazione COVID-19 sono stati valutati utilizzando questi metodi statistici. Il cIR è stato calcolato
come il verificarsi di eventi ogni 10.000 individui. Per valutare l’associazione tra vaccinazione COVID-19 ed eventi avversi, abbiamo impiegato un modello di regressione logistica multipla per stimare gli odds ratio (OR) con corrispondenti intervalli di confidenza (IC) del 95%. Inoltre, è stata utilizzata la regressione dei rischi proporzionali di Cox per stimare gli hazard ratio (HR) con IC del 95%. Sia per i modelli di regressione logistica multipla che per quelli di regressione dei rischi proporzionali di Cox, le comorbilità sono state incluse come covariate per aggiustare i potenziali fattori confondenti.
Un modello bilaterale P-valore di≤ 0,05 è stato considerato statisticamente significativo.
3. Risultati
3.1. Le caratteristiche dei partecipanti
In totale, 1.748.136 soggetti sono stati inclusi in questo studio. Tra questi, 289.579 (16,57%) non avevano ricevuto il vaccino COVID-19 (vale a dire, soggetti non vaccinati), mentre 1.458.557 (83,43%) erano vaccinati contro COVID-19 (vale a dire, soggetti vaccinati) (Figura1). Le caratteristiche di base dei gruppi vaccinati e non vaccinati sono mostrate nella Tabella1.

3.2. I cIR per 10.000 degli AE non graviDopo il vaccino COVID-19 azione
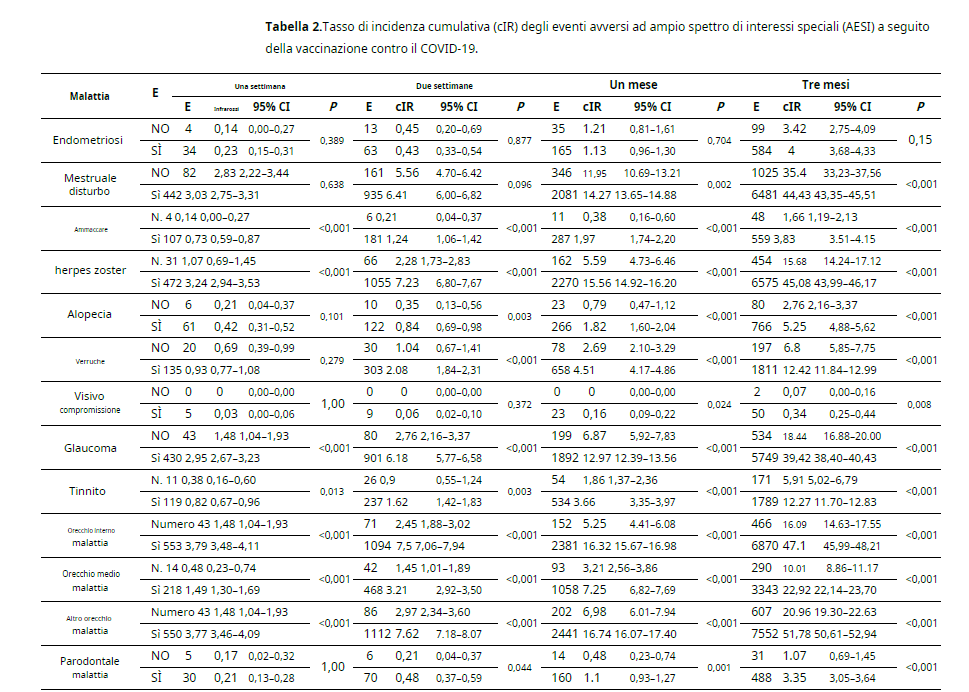
Tra gli AE ad ampio spettro in questo studio, i cIR a tre mesi dalla vaccinazione COVID-19 erano più alti nei soggetti vaccinati rispetto ai soggetti non vaccinati, fatta eccezione per l’endometriosi. Il cIR più alto delle AESI ad ampio spettro nei vaccinati soggetti è stata osservata in altre malattie dell’orecchio (cIR, 51,78; 95% CI, 50,61–52,94) seguite da malattie dell’orecchio interno (cIR, 47,10; 95% CI, 45,99–48,21), herpes zoster (cIR, 45,08; 95% CI, 43,99–46,17), disturbi mestruali (cIR, 44,43; 95% CI, 43,35–45,51) e glaucoma (cIR, 39,42; 95% CI, 38,40–40,43).
Tra le AESI ad ampio spettro, il 50% ha mostrato una differenza significativa nei cIR una settimana dopo la vaccinazione. Disturbi mestruali e deficit visivi sono stati osservati per un mese, mentre alopecia, verruche e malattia parodontale sono stati osservati da due settimane in poi (Tabella2).

Quando stratificati per genere, i cIR delle AESI ad ampio spettro hanno mostrato un andamento simile a quello della popolazione complessiva. A tre mesi dalla vaccinazione, i disturbi mestruali presentavano i cIR più elevati nelle femmine (cIR, 87,54; IC al 95%, 85,41–89,66) seguiti dalle malattie dell’orecchio interno nelle femmine (cIR, 62,82; IC al 95%, 61,02–64,62), altre malattie dell’orecchio nelle femmine (cIR, 55,27; IC al 95%, 53,58–56,96) e herpes zoster nelle femmine (cIR, 53,13; IC al 95%, 51,48– 54,79) (Tabella S1). Quando stratificata per tipo di vaccino, la vaccinazione eterologa ha aumentato il cIR dei disturbi mestruali a 78,96 (95% CI, 73,45–84,48) (Tabella S2). Ulteriori informazioni dettagliate sul rischio di AE in base al genere sono presentate nella Tabella S3.
3.3. I rischi di eventi avversi non gravi a seguito della vaccinazione contro il COVID-19
Nel modello di rischio proporzionale di Cox in questo studio, la vaccinazione contro il COVID-19 ha aumentato significativamente i rischi di AESI ad ampio spettro, ad eccezione dei deficit visivi (HR, 3,94; IC al 95%, 0,94-16,41), con il livello più alto di alopecia (HR, 2,40; IC al 95%, 1,90-3,03) seguito da malattie dell’orecchio interno (HR, 2,37; IC al 95%, 2,15-2,60) e herpes zoster (HR, 2,34; IC al 95%, 2,12-2,57) (Figura 2A). Nel modello logistico multivariato di questo studio, la vaccinazione anti-COVID-19 è stata associata a un aumento significativo del rischio della maggior parte delle AESI ad ampio spettro, indicando una potenziale influenza nel punto temporale iniziale (una settimana dopo la vaccinazione anti-COVID-19). A tre mesi dalla vaccinazione, la vaccinazione anti-COVID-19 ha aumentato significativamente il rischio di endometriosi (OR, 1,63; IC al 95%, 1,31-2,03). Inoltre, la compromissione della vista a tre mesi (OR, 3,96; IC al 95%, 0,95-16,50), l’acufene a una settimana (OR, 1,84; IC al 95%, 0,98-3,45) e due settimane (OR, 1,51; IC al 95%, 1,00-2,29) e le malattie parodontali a una settimana (OR, 0,97; IC al 95%, 0,37-2,55), due settimane (OR, 1,77; IC al 95%, 0,76-4,13) e un mese (OR, 1,66; IC al 95%, 0,96-3,04) non hanno mostrato differenze statistiche di OR tra i due gruppi (Figura2B).

3.4. I rischi degli AESI ad ampio spettro in base al tipo di vaccino COVID-19
Per valutare i fattori di rischio in base al tipo di vaccino COVID-19 sono stati utilizzati sia il modello di regressione logistica multivariata sia il modello di rischi proporzionali di Cox. Nel modello di rischio proporzionale di Cox, la vaccinazione eterologa ha aumentato maggiormente i rischi di problemi ginecologici, tra cui endometriosi (HR, 2,78; IC al 95%, 2,08-3,72]) e disturbi mestruali (HR, 2,84; IC al 95%, 2,58-3,12]), problemi ematologici tra cui lividi (HR, 1,89; IC al 95%, 1,21-2,96), problemi dermatologici tra cui herpes zoster (HR, 2,89; IC al 95%, 2,15-2,60) e alopecia (HR, 3,41; IC al 95%, 2,52-4,62), problemi oftalmologici tra cui glaucoma (HR, 1,83; IC al 95%,
1,60-2,09) e malattie parodontali (HR, 3,56; 95% CI, 2,18–5,82) rispetto ad altri tipi di vaccinazione (Figura3A). Nel modello di regressione logistica multivariata, la maggior parte delle tendenze di rischio ha mostrato un andamento simile a quello dei modelli di rischio proporzionale di Cox. In base ai punti temporali, l’alopecia e le malattie parodontali sono state associate ai risultati di rischio più elevati a seguito di vaccinazioni eterologhe rispetto ad altri metodi di vaccinazione. Tuttavia, è stato osservato che la vaccinazione con solo cDNA aumentava notevolmente i rischi di lividi a una settimana (OR [95% CI] = 5,77 [2,01-16,54]), due settimane (HR, 6,26; 95% CI, 2,28-14,62) e un mese (HR, 5,00; 95% CI, 2,66-9,39]) (Figura3B).

4. Discussion
4.1. Risultati della ricerca e implicazioni cliniche
Lo sviluppo di vaccini COVID-19 è stato cruciale nel superare la pandemia di COVID-19 riducendo la gravità della malattia e la mortalità. In altre parole, mentre i vaccini COVID-19 hanno apportato contributi significativi ai benefici della salute pubblica a livello globale, ci sono stati anche rapporti che esprimevano preoccupazioni sulla loro sicurezza a causa della velocità senza precedenti del loro sviluppo. Le preoccupazioni per le complicanze post-sequela e correlate al vaccino sono state sollevate come una delle questioni globali importanti [1,9]. L’attenzione principale sulle complicazioni legate al vaccino COVID-19 erano gli eventi avversi gravi, come problemi cardiovascolari e neurologici che possono dare origine a condizioni fatali [6,7]. Per quanto ne sappiamo, la ricerca sugli eventi avversi non gravi conseguenti alla vaccinazione contro il COVID-19 non ha condotto un ampio studio di coorte basato sulla popolazione a livello nazionale [10]. Qui, abbiamo esaminato i 14 AE non gravi successivi alla vaccinazione contro il COVID-19 a Seoul, Corea del Sud.
Confrontando i 1.458.557 soggetti vaccinati e i 289.579 soggetti non vaccinati, abbiamo scoperto che gli AE ad ampio spettro, ad eccezione dell’endometriosi, hanno mostrato un aumento significativo dell’incidenza cumulativa dopo la vaccinazione contro il COVID-19 con tassi notevolmente più elevati di disturbi mestruali, herpes zoster, glaucoma, malattie dell’orecchio interno, malattie dell’orecchio medio e altre malattie dell’orecchio rispetto ai soggetti non vaccinati.
Inoltre, i lividi sono associati alla vaccinazione contro il COVID-19 nella fase iniziale, mostrando gli OR più elevati in una settimana e due settimane. Per tre mesi di follow-up, l’alopecia ha mostrato il livello più elevato di HR dopo la vaccinazione contro il COVID-19. Pertanto, i nostri risultati indicano che gli AE non gravi si verificano comunemente durante il periodo acuto post-vaccinazione. Tuttavia, anche se il rischio sembra elevato, il nostro studio non tiene conto della gravità di ciascuna condizione, rendendo necessaria un’interpretazione cauta.
Lee et al. hanno presentato lievi eventi avversi a seguito della vaccinazione contro il COVID-19, mostrando sintomi correlati alla pelle (23,6%) [10]. Questi risultati sono coerenti con i nostri risultati sui disturbi correlati alla pelle come i lividi. Nel frattempo, per gli AE lievi, le donne hanno incidenze più elevate rispetto agli uomini [10].
Gli AE non gravi ad ampio spettro in questo studio (Tabella S1) hanno dimostrato che le femmine hanno cIs più elevati rispetto ai maschi, supportando uno studio precedente [10]. Inoltre, quasi tutti gli AE hanno mostrato un rischio significativamente aumentato indipendentemente dal tipo di vaccino, sebbene l’entità del rischio variasse a seconda del tipo di vaccino, in linea con studi precedenti [10]. In particolare, il nostro studio ha analizzato ulteriormente i modelli in diversi periodi di tempo, suggerendo che il livello di rischio potrebbe cambiare nel tempo.
4.2. Il tipo di vaccinazione con l’associazione della risposta immunitaria
Il tipo di vaccinazione è stato associato alla risposta immunitaria dati i meccanismi cellulari [ 13,23]. Lee et al. hanno dimostrato che la vaccinazione eterologa porta a risposte arricchite delle cellule B e delle cellule T CD4+ con una maggiore attivazione delle vie dell’interferone, suggerendo il potenziale aumento degli irAE [24]. In questo studio per gli AE ad ampio spettro, la vaccinazione eterologa ha mostrato i rischi più elevati di otto AE, tra cui endometriosi, disturbi mestruali, lividi, herpes zoster, alopecia, glaucoma e malattie parodontali, rispetto ad altri tipi di vaccinazione. Pertanto, le lesioni del sangue periferico e della pelle possono mostrare risposte immunitarie più elevate a seguito della vaccinazione eterologa.
4.3. Il ruolo della proteina Spike nei vaccini COVID-19
La proteina spike è considerata un bersaglio primario per lo sviluppo di vaccini contro il COVID-19 perché l’infezione da coronavirus della sindrome respiratoria acuta grave 2 (SARS-CoV-2) è avviata dal legame della proteina spike al recettore ACE2 sulla superficie della cellula ospite [23,25]. Yonker et al. hanno suggerito che la proteina spike circolante è stata rilevata nel sangue periferico dei pazienti che hanno sviluppato miocardite post-vaccino a mRNA [25]. Diversi studi a supporto di Yonker et al. forniscono potenziali approfondimenti sulla possibilità che mRNA-LNP possa agire come una potenziale causa sottostante per diversi AE [25–32]. La principale differenza tra i vaccini basati su cDNA e quelli basati su mRNA contro SARS-CoV-2 era rappresentata dai mediatori delle risposte immunitarie, che erano rispettivamente la proteina spike e l’mRNA incapsulato in nanoparticelle lipidiche [23]. L’ipotesi attuale tra la vaccinazione COVID-19 e le malattie dell’orecchio come AE è che la malattia dell’orecchio sia attivata dall’intensificazione di una proteina spike specifica IgG e da una potenziale risposta immunitaria sistemica, suggerendo importanti fattori immunologici [29]. Sorprendentemente, in questo studio, la maggior parte dei problemi alle orecchie, tra cui tinnito, malattie dell’orecchio interno e malattie dell’orecchio medio, hanno mostrato un alto livello di HR nella vaccinazione utilizzando solo cDNA rispetto ad altri tipi di vaccinazione. I risultati di questo studio non sono solo coerenti con le ipotesi esistenti che indicano l’importante ruolo della proteina spike nel SARS-CoV-2. Tuttavia, poiché i nostri risultati si basano su dati osservativi, la relazione causale deve essere ulteriormente chiarita in studi futuri.
4.4. Eventi avversi ginecologici
Per quanto riguarda i problemi ginecologici, studi precedenti hanno suggerito che la vaccinazione contro il COVID-19 ha aumentato il sanguinamento dovuto ai cambiamenti nel ciclo mestruale irregolare [30]. Studi basati sulla popolazione hanno riportato che sanguinamenti vaginali inaspettati e cambiamenti nel sanguinamento mestruale sono un fenomeno emergente [27,28]. In particolare, i cambiamenti mestruali causati dalla vaccinazione contro il COVID-19 potrebbero essere potenzialmente preoccupanti per le donne più giovani, poiché potrebbero avere effetti negativi sulla fertilità. Le mestruazioni e l’ovulazione sono causate da un’infiammazione fisiologica, che è correlata al TNF-α per la follicologenesi, all’IL-6 e -8 per la secrezione degli ormoni ovarici e alle cellule T regolatrici per la fase luteale [33]. La proteina spike si lega all’enzima di conversione dell’angiotensina-2 e svolge un ruolo nella tempesta di citochine [34]. Pertanto, queste tempeste di attivazione delle cellule immunitarie e citochine possono potenzialmente disregolare le mestruazioni.[33,34].
Allo stesso modo, il nostro studio ha anche mostrato un aumento di cIR e rischi di disturbi mestruali (tra cui menorragia, metrorragia e ipermenorrea), che sono aumentati significativamente con le vaccinazioni eterologhe. Considerando studi precedenti, queste manifestazioni sono state causate da cambiamenti ormonali derivanti da proteine spike e interruzione del percorso di coagulazione nell’endometrio [27,28]. Sebbene non vi fossero differenze significative nel cIR dell’endometriosi a tre mesi tra soggetti vaccinati e non vaccinati, questo studio ha rivelato un aumento del rischio di endometriosi associato alla vaccinazione contro il COVID-19 a tre mesi dalla vaccinazione. Questi risultati suggeriscono che il cIR dell’endometriosi potrebbe vedere un aumento significativo oltre i tre mesi. D’altro canto, l’alopecia, nonostante un aumento significativo del rischio, ha mostrato un graduale declino nel tempo. Ciò suggerisce che l’andamento temporale del rischio potrebbe variare a seconda della condizione durante il follow-up a lungo termine. Pertanto, condurre analisi a lungo termine per osservare le tendenze epidemiologiche sarà fondamentale nella ricerca futura.
4.5. Eventi avversi dermatologici
Uno dei punti importanti per questo risultato è stato il trend del rischio decrescente di lividi dopo la vaccinazione. Inoltre, il livido associato al vaccino COVID-19 presentava lividi di colore giallo non dolenti, soprattutto sulle estremità. In particolare, il rischio di lividi è più alto circa due settimane dopo la vaccinazione e poi diminuisce. Questo schema suggerisce che è necessario un attento monitoraggio durante il periodo acuto post-vaccinazione. Pertanto, sia i medici che i soggetti vaccinati devono essere cauti nel caso di lividi entro un mese dalla vaccinazione. Inoltre, la vaccinazione con cDNA ha aumentato significativamente i rischi di lividi solo nella fase iniziale rispetto ad altri tipi, quindi potrebbe essere necessaria particolare cautela nei soggetti vaccinati che utilizzano il vaccino cDNA per almeno due settimane dopo la vaccinazione.
Considerando che il rischio della maggior parte degli eventi avversi dermatologici è aumentato in modo significativo a seguito della vaccinazione contro il COVID-19, il possibile meccanismo è il mimetismo molecolare causato dalla proteina spike [17,35]. Questo fenomeno può potenzialmente portare ad un aumento del rischio di eventi avversi autoimmuni, come riportato in letteratura [35]. In linea con questo, crediamo che l’attivazione delle cellule T possa essere cruciale per il verificarsi di eventi avversi dermatologici correlati al vaccino COVID-19 [17]. Sebbene i nostri risultati presentino una limitazione in quanto studio osservazionale, i meccanismi biologici plausibili suggeriti potrebbero essere verificati in futuro.
4.6. Punti di forza di questo studio
Il nostro studio presenta diversi punti di forza per gli AE ad ampio spettro successivi alla vaccinazione contro il COVID-19. Innanzitutto, gli AESI ad ampio spettro sono stati segnalati come case report o serie di casi, quindi è il primo studio a esaminare gli AE ad ampio spettro che non sono gravi ma comuni dopo la vaccinazione contro il COVID-19 [13–15,20,29,31]. Per diverse manifestazioni, tra cui il glaucoma post-vaccinazione, le malattie dell’orecchio e l’alopecia, questi AE condividevano potenziali meccanismi patofisiologici come espressione di proteine spike, che sono associate alla disregolazione dell’immunità [13,15,32]. Con i meccanismi suggeriti in letteratura, i nostri studi potrebbero essere coerenti con questa ipotesi perché i tipi di vaccinazioni hanno HR più elevati nella vaccinazione eterologa o cDNA rispetto alla vaccinazione solo mRNA. Tuttavia, la nostra ipotesi relativa a questa associazione deve essere convalidata attraverso futuri studi sperimentali. In secondo luogo, gli studi attuali hanno dimostrato che il vaccino COVID-19 influenza la risposta immunitaria mediata dalle cellule T nella sclerosi multipla, che porta all’autoimmunità [ 19]. I nostri risultati per gli AE ad ampio spettro rafforzano i loro studi, condividendo meccanismi e ipotesi patofisiologici simili, come il ruolo delle proteine spike e delle malattie autoimmuni innescate dai vaccini. Tuttavia, la relazione causale deve essere verificata in futuro. Infine, gli AE non gravi dopo la vaccinazione COVID-19 sono relativamente comune e può essere influenzato da vari fattori come i metodi di vaccinazione [19]. Inoltre, i nostri risultati suggeriscono anche che diversi tipi di vaccinazioni mostrano distinti modelli di attivazione in vari siti, che dovranno essere studiati in futuro. Anche in questo caso, le verruche sulla guancia sono state sviluppate con positività per spike IgG e negative per nucleocapside IgG dopo vaccinazione basata su mRNA, suggerendo che l’mRNA-LNP innesca una risposta autoimmune [18] .
I vaccini anti-COVID-19 potrebbero non essere fatali, ma gli individui predisposti potrebbero essere più vulnerabili a un’ampia gamma di AE. Inoltre, il nostro studio indica che è essenziale considerare i potenziali effetti collaterali che persistono oltre i tre mesi. Man mano che la tossicità del COVID-19 diminuisce e una parte significativa della popolazione mondiale acquisisce un’immunità naturale, è importante designare come destinatari del vaccino coloro per i quali i benefici della vaccinazione superano i potenziali effetti collaterali della vaccinazione in corso.
4.7. Limitazioni di questo studio
Questo studio presenta diverse limitazioni. Innanzitutto, il nostro studio presenta una diseguaglianza statistica tra i due gruppi, causata da uno studio generale basato sulla popolazione. Uno degli scopi principali di questo studio è quello di segnalare l’incidenza cumulativa di AE non gravi ad ampio spettro nella popolazione residente a Seoul, Corea del Sud, come analisi preliminare utilizzando dati grezzi. Tuttavia, per gli AESI ad ampio spettro che non sono gravi ma comuni, gli studi sulla popolazione di grandi dimensioni erano scarsi, quindi gli studi attraverso il processo di abbinamento del punteggio di propensione potrebbero essere necessari per la ricerca futura come un nuovo articolo. In secondo luogo, gli AE target sono stati estratti in base ai codici ICD-10 nei database delle richieste, quindi potrebbero essersi verificati errori di codifica, disadattamento o di classificazione errata. In terzo luogo, abbiamo cercato di AE non gravi ad ampio spettro dopo la vaccinazione contro il COVID-19, ma esiste la possibilità che alcune malattie potrebbero non essere incluse. Inoltre, il nostro studio non ha fornito un’analisi dei sottogruppi in base ad età, sesso e intervalli tra la prima e la seconda vaccinazione. Infine, in questo studio non sono stati considerati ulteriori fattori confondenti, come malattie autoimmuni o fattori sociali, che potrebbero potenzialmente determinare un bias di selezione, incluso il bias del vaccino sano. Sono necessari studi a lungo termine sulla durata degli AE e sugli effetti collaterali correlati alle malattie infiammatorie che non sono comparsi nella durata a breve termine, che sono in corso per chiarire gli AE della vaccinazione contro il COVID-19. Queste limitazioni nel nostro studio dovrebbero essere illustrate attraverso nuove ricerche per specialità in futuro.
5. Conclusioni
I rischi a tre mesi di AE non gravi ad ampio spettro incidentali sono sostanzialmente più alti nei soggetti vaccinati contro il COVID-19 rispetto ai controlli non vaccinati. I nostri risultati hanno suggerito che i soggetti vaccinati con predisposizione sono potenzialmente vulnerabili al verificarsi di diversi AE, sebbene i vaccini contro il COVID-19 possano non essere fatali. Di conseguenza, i medici dovrebbero mantenere un monitoraggio ravvicinato degli AE ad ampio spettro dopo la vaccinazione, dato che queste manifestazioni potrebbero emergere dopo la vaccinazione.
Materiali supplementari:Le seguenti informazioni di supporto possono essere scaricate all’indirizzo: https://
www.mdpi.com/article/10.3390/jcm14051767/s1Tabella S1:
Tassi di incidenza cumulativa di eventi avversi non fatali correlati al sistema immunitario stratificati per genere; Tabella S2: Tassi di incidenza cumulativa di eventi avversi non fatali correlati al sistema immunitario stratificati per tipo di vaccino; Tabella S3: Rischio di eventi avversi non gravi per genere.
Riferimenti
- Gupta, A.; Madhavan, MV; Sehgal, K.; Nair, N.; Mahajan, S.; Sehrawat, Texas; Bikdeli, B.; Ahluwalia, N.; Ausiello, JC; pallido,
EY; et al. Manifestazioni extrapolmonari del COVID-19.Medico Naz.2020,26, 1017–1032.Riferimento incrociato] [Pubblicazione] - Feikin, DR; Higdon, MM; Abu-Raddad, LJ; Andrews, N.; Araos, R.; Goldberg, Y.; Groome, MJ; Huppert, A.; O’Brien,
KL; Smith, PG; et al. Durata dell’efficacia dei vaccini contro l’infezione da SARS-CoV-2 e la malattia da COVID-19: risultati di una revisione
sistematica e meta-regressione.Lancetta2022,399, 924–944.Riferimento incrociato] - Voysey, M.; Clemente, SAC; Madhi, Sudafrica; Weckx, LY; Folegatti, PM; Aley, PK; Angus, B.; Baillie, VL; Barnaba, SL; Borat,
QE; et al. Sicurezza ed efficacia del vaccino ChAdOx1 nCoV-19 (AZD1222) contro SARS-CoV-2: un’analisi provvisoria di quattro studi clinici
randomizzati condotti in Brasile, Sudafrica e Regno Unito.Lancetta2021,397, 99–111.Riferimento incrociato] [Pubblicazione] - Baden, LR; El Sahly, HM; Essink, B.; Kotloff, K.; Frey, S.; Novak, R.; Diemert, D.; Spector, SA; Rouphael, N.; Creech, CB; et al. Efficacia e sicurezza del
vaccino mRNA-1273 SARS-CoV-2.Laurea in ingegneria meccanica2021,384, 403–416.Riferimento incrociato] - Tommaso, SJ; Moreira, ED, Jr.; Kitchin, N.; Absalon, J.; Gurtman, A.; Lockhart, S.; Perez, JL; Perez Marc, G.; Polacco, FP; Zerbini,
C.; et al. Sicurezza ed efficacia del vaccino BNT162b2 mRNA contro il Covid-19 a 6 mesi.Laurea in ingegneria meccanica2021,385, 1761–1773.Riferimento
incrociato] - Patone, M.; Handunnetthi, L.; Saatci, D.; Pan, J.; Katikireddi, SV; Razvi, S.; Hunt, D.; Mei, XW; Dixon, S.; Zaccardi, F.; et al. Complicanze
neurologiche dopo la prima dose di vaccino COVID-19 e infezione da SARS-CoV-2.Medico Naz.2021,27, 2144–2153.Riferimento
incrociato] [Pubblicazione] - Wang, W.; Wang, CY; Wang, SI; Wei, JC Risultati cardiovascolari a lungo termine nei sopravvissuti al COVID-19 tra la popolazione non vaccinata: uno
studio di coorte retrospettivo delle reti collaborative statunitensi TriNetX.MedicinaEcologica2022,53, 101619.Riferimento incrociato] - Cho, JY; Kim, KH; Lee, N.; Cho, SH; Kim, SY; Kim, EK; Parco, JH; Choi, EY; Choi, JO; Parco, H.; et al. Miocardite correlata alla vaccinazione
COVID-19: uno studio nazionale coreano.Eur. Cuore J.2023,44, 2234–2243.Riferimento incrociato] - Jung, J. Preparazione alla vaccinazione contro la malattia da coronavirus (COVID-19): prove, piani e implicazioni.J. Dottore in medicina e scienze coreane 2021,36, e59.
Riferimento incrociato] - Lee, DS; Kim, JW; Lee, KL; Jung, YJ; Kang, HW Eventi avversi successivi alla vaccinazione anti-COVID-19 in Corea del Sud tra il 28 febbraio e il 21
agosto 2021: uno studio osservazionale a livello nazionale.Int. J. Infezione Dis.2022,118, 173–182.Riferimento incrociato] - Sharifian-Dorche, M.; Bahmanyar, M.; Sharifian-Dorche, A.; Mohammadi, P.; Nomovi, M.; Mowla, A. Trombocitopenia trombotica immune indotta
da vaccino e trombosi del seno venoso cerebrale dopo vaccinazione COVID-19; una revisione sistematica.Scienze Neurologiche2021,428,
117607.Riferimento incrociato] [Pubblicazione] - Ewer, KJ; Barrett, JR; Belij-Rammerstorfer, S.; Sharpe, H.; Makinson, R.; Morter, R.; Flaxman, A.; Wright, D.; Bellamy, D.; Bittaye,
M.; et al. Risposte delle cellule T e degli anticorpi indotte da una singola dose di vaccino ChAdOx1 nCoV-19 (AZD1222) in uno studio clinico di fase 1/2.
Medico Naz.2021,27, 270–278.Riferimento incrociato] - Li, C.; Lee, A.; Grigoryan, L.; Arunachalam, PS; Scott, MKD; Trisal, M.; Wimmers, F.; Sanyal, M.; Weidenbacher, Pennsylvania; Feng,
Y.; et al. Meccanismi di immunità innata e adattativa al vaccino Pfizer-BioNTech BNT162b2.Immunolo Nat.2022,23, 543–555.Riferimento
incrociato] - Singh, RB; Parmar, UPS; Kahale, F.; Agarwal, A.; Tsui, E. Uveite associata al vaccino dopo la vaccinazione contro il COVID-19: analisi del database del sistema
di segnalazione degli eventi avversi dei vaccini.Oftalmologia2023,130, 179–186.Riferimento incrociato] [Pubblicazione]
- Wichova, H.; Miller, ME; Derebery, MJ Manifestazioni otologiche dopo la vaccinazione contro il COVID-19: l’esperienza della clinica otorinolaringoiatrica. Otol. Neurotolo.
2021,42, e1213–e1218.Riferimento incrociato] - Fazlollahi, A.; Zahmatyar, M.; Noori, M.; Nejadghaderi, SA; Sullman, MJM; Shekarriz-Foumani, R.; Kolahi, AA; Singh, K.; Safiri, S.
Complicanze cardiache successive ai vaccini mRNA COVID-19: una revisione sistematica di segnalazioni di casi e serie di casi.Rev. Med.
Virol.2022,32, e2318.Riferimento incrociato] - Genco, L.; Cantelli, M.; Noto, M.; Battista, T.; Patrio,UN.; Fabbrocini, G.; Vastarella, M. Alopecia Areata dopo i vaccini COVID-19. Sci. Disturbo
dell’appendice.2023,9, 141–143.Riferimento incrociato] - Cazzato, G.; Romita, P.; Foti, C.; Lobreglio, D.; Trilli, I.; Colagrande, A.; Ingravallo, G.; Resta, L. Sviluppo di verruche piane sulle guance dopo il
vaccino BioNTech-Pfizer BNT162b2: esiste una correlazione?Vaccini2022,10, 532.Riferimento incrociato] [Pubblicazione] - Toljan, K.; Amin, M.; Kunchok, A.; Ontaneda, D. Nuova diagnosi di sclerosi multipla nel contesto dell’esposizione al vaccino mRNA COVID-19.J.
Neuroimmunol.2022,362, 577785.Riferimento incrociato] - Gallo, G.; Mastorino, L.; Tonella, L.; Ribero, S.; Quaglino, P. Alopecia areata dopo la vaccinazione COVID-19.Vaccino sperimentale clinico. 2022,11, 129–132.
Riferimento incrociato] - von Elm, E.; Altman, DG; Egger, M.; Pocock, SJ; Gøtzsche, PC; Vandenbroucke, JP Dichiarazione STROBE (Strengthening the Reporting of
Observational Studies in Epidemiology): Linee guida per la segnalazione di studi osservazionali.Lancetta2007,370, 1453–1457.Riferimento
incrociato] [Pubblicazione] - Sundararajan, V.; Henderson, T.; Perry, C.; Muggivan, A.; Quan, H.; Ghali, WA La nuova versione ICD-10 dell’indice di comorbilità di Charlson ha
previsto la mortalità ospedaliera.Epidemiologia2004,57, 1288–1294.Riferimento incrociato] - Seyed Hosseini, E.; Riahi Kashani, N.; Nikzad, H.; Azadbacht, J.; Hassani Bafrani, H.; Haddad Kashani, H. Il romanzo coronavirus Disease-2019
(COVID-19): meccanismo d’azione, rilevamento e recenti strategie terapeutiche.Virologia2020,551, 1–9.Riferimento incrociato] - Lee, HK; Go, J.; Sung, H.; Kim, SW; Walter, M.; Knabl, L.; Furth, PA; Hennighausen, L.; Huh, JW La vaccinazione eterologa ChAdOx1-BNT162b2 nella
coorte coreana induce robuste risposte immunitarie e anticorpali che includono Omicron.iScienza2022,25, 104473.Riferimento incrociato] [
Pubblicazione] - Yonker, LM; Swank, Z.; Bartsch, YC; Burns, MD; Kane, A.; Boribong, BP; Davis, JP; Loiselle, M.; Novak, T.; Senussi, Y.; et al. Proteina Spike
circolante rilevata nella miocardite post-vaccino a mRNA per COVID-19.Circolazione2023,147, 867–876.Riferimento incrociato] - Ndeupen, S.; Qin, Z.; Jacobsen, S.; Bouteau, A.; Estanbouli, H.; Igyártó, BZ Il componente nanoparticellare lipidico della piattaforma mRNA-LNP utilizzato
negli studi preclinici sui vaccini è altamente infiammatorio.iScienza2021,24, 103479.Riferimento incrociato] [Pubblicazione] - Blix, K.; Laak, I.; Juvet, L.; Robertson, AH; Caspersen, IH; Mjaaland, Sud; Skodvin, SN; Magnus, P.; Feiring, B.; Trogstad, L. Sanguinamento vaginale
inaspettato e vaccinazione COVID-19 nelle donne senza mestruazioni.Sci. Avv.2023,9, eadg1391.Riferimento incrociato] - Lee, KMN; Junkins, EJ; Luo, C.; Fatima, UA; Cox, ML; Clancy, KBH Indagine sulle tendenze nelle donne che manifestano cambiamenti nelle mestruazioni dopo
la vaccinazione contro SARS-CoV-2.Sci. Avv.2022,8, eabm7201.Riferimento incrociato] - Ciorba, A.; Corazzi, V.; Bianchini, C.; Aimoni, C.; Pelucchi, S.; Skarżyński, PH; Hatzopoulos, S. Malattia autoimmune dell’orecchio interno (AIED): una
sfida diagnostica.Int. J. Immunopatologico Farmaco.2018,32, 2058738418808680.Riferimento incrociato] - Farland, LV; Khan, SM; Shilen, A.; Heslin, KM; Ishimwe, P.; Allen, AM; Herbst-Kralovetz, MM; Mahnert, ND; Pogreba-Brown, K.; Ernst, KC; et
al. Vaccinazione anti-COVID-19 e cambiamenti nel ciclo mestruale tra le persone vaccinate.Fertile. Sterile. 2023,119, 392–400.
Riferimento incrociato] - Su, YW; Yeh, SJ; Chen, MJ Glaucoma di nuova insorgenza a seguito della vaccinazione Moderna contro il COVID-19.Medico chirurgo specialista in glaucoma.2023,17, 106–109.
Riferimento incrociato] [Pubblicazione] - Mulroney, TE; Pöyry, T.; Yam-Puc, JC; Rust, M.; Harvey, RF; Kalmar, L.; Horner, E.; Booth, L.; Ferreira, AP; Stoneley, M.; et al. La N(1)-metilpseudouridilazione
dell’mRNA causa lo spostamento del frame ribosomiale +1.Natura2024,625, 189–194.Riferimento incrociato] [Pubblicazione] - Rahimi Mansour, F.; Keyvanfar, A.; Najafiarab, H.; Rajaei Firouzabadi, S.; Sefidgar, S.; Hooshmand Chayijan, S.; Tarom, M.; Fadaei, M.;
Farzaneh, F.; Karimzadeh Bardeei, L.; et al. Disturbi mestruali a seguito della vaccinazione COVID-19: un probabile enigma sul ruolo
delle vie endocrine e immunitarie.J. Riproduzione Immunologica.2023,158, 103952.Riferimento incrociato] [Pubblicazione] - Mulroney, TE; Pöyry, T.; Yam-Puc, JC; Rust, M.; Harvey, RF; Kalmar, L.; Horner, E.; Booth, L.; Ferreira, AP; Stoneley, M. Gli effetti incombenti degli
estrogeni nel Covid-19: un lancio difficile.Anteriore. Nutr.2021,18, 649128.Riferimento incrociato] - Kim, HJ; Kim, MH; Park, SJ; Choi, MG; Chun, EM Evento avverso autoimmune a seguito della vaccinazione anti-COVID-19 a Seul, Corea del Sud.Clinica di
allergologia, immunologia.2024,156, 1711–1720.Riferimento incrociato]
L’articolo citato