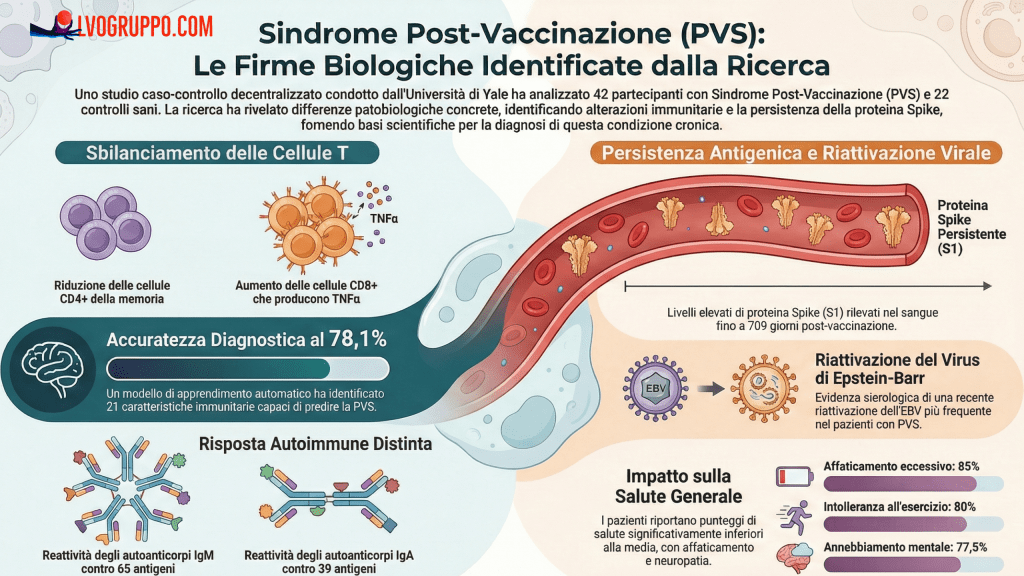
L’ivermectina è stata inizialmente utilizzata come farmaco veterinario, dimostrando efficacia contro diversi parassiti. Il cancro al pancreas è attualmente una delle malattie più recalcitranti. Lo scopo del presente studio era dimostrare la sinergia della combinazione di metioninasi ricombinante (rMETase) e ivermectina per eradicare le cellule tumorali pancreatiche umane in vitro.
LO STUDIO SU PUBMED CHE TROVATE TRADOTTO IN ITALIANO A FONDO PAGINA
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE…
Materiali e metodi: Le cellule tumorali pancreatiche umane MiaPaCa-2 sono state coltivate in terreno di coltura di Eagle modificato di Dulbecco (DMEM) con l’aggiunta del 10% di siero bovino fetale e 1 UI/ml di penicillina/streptomicina. La riduzione della vitalità cellulare da parte di rMETase da sola e ivermectina da sola e la loro combinazione sulle cellule MiaPaCa-2 è stata determinata con il reagente WST. Quattro gruppi sperimentali sono stati esaminati in vitro: gruppo di controllo senza trattamento; ivermectina da sola; rMETase da sola; ivermectina in combinazione con rMETase. Risultati: L’IC50
dell’ivermectina per le cellule MiaPaCa-2 era di 5,9 μM. L’IC50
di rMETase sulle cellule MiaPaCa-2 era di 2,93 U/ml. L’ivermectina (5,9 μM) più rMETase (2,93 U/ml) hanno sinergicamente ridotto significativamente la vitalità delle cellule MiaPaCa-2, rispetto alla sola ivermectina (riduzione dell’80% vs. riduzione del 45%, rispettivamente p<0,05). Conclusione: La combinazione di ivermectina e rMETase ha efficacemente eradicato le cellule di carcinoma pancreatico MiaPaCa-2. I risultati attuali indicano il potenziale clinico futuro della combinazione di rMETase, attualmente somministrata per via orale ai pazienti come integratore alimentare, e ivermectina orale sul carcinoma pancreatico.
L’ivermectina è stata inizialmente utilizzata come farmaco veterinario e si è dimostrata altamente efficace contro vari parassiti, tra cui ascaridi gastrointestinali, vermi polmonari e acari ( 1 ). Il premio Nobel è stato assegnato a Satoshi Omura e William C. Campbell nel 2015 per l’ivermectina come nuova terapia contro i parassiti degli ascaridi ( 1 ). L’ivermectina induce l’arresto del ciclo cellulare e l’apoptosi nelle cellule HeLa attraverso una via mitocondriale ( 2 ). L’ivermectina ha anche mostrato efficacia antitumorale contro il cancro del colon, il cancro al seno, il cancro ovarico, il melanoma e la leucemia in studi preclinici ( 3 ).
La dipendenza da metionina nel cancro, nota anche come effetto Hoffman, è un segno distintivo fondamentale e generale del cancro ( 4 ). Numerosi studi hanno dimostrato che la metioninasi ricombinante (rMETase), il terreno privo di metionina o una dieta a basso contenuto di metionina sono sinergici con la chemioterapia per tutti i principali tipi di cancro, sia in studi preclinici che in clinica ( 5 – 24 ). Recentemente abbiamo dimostrato che la combinazione di rMETase con farmaci chemioterapici può invertire sinergicamente la resistenza delle cellule tumorali a farmaci tra cui eribulina, trabectedina, docetaxel e doxorubicina ( 5 , 12 – 13 , 15 , 16 ).
Il cancro al pancreas è uno dei tumori più difficili da trattare al mondo, altamente aggressivo e con una prognosi sfavorevole. Le terapie mirate, come gli inibitori di KRAS, sono state valutate in modelli preclinici e studi clinici di fase iniziale per il cancro al pancreas ( 25 ). Gli inibitori dei checkpoint immunitari e le terapie con cellule CAR T sono stati testati sulle cellule tumorali del pancreas ( 26 ). Tuttavia, il cancro al pancreas rimane recalcitrante, con un alto tasso di mortalità e opzioni limitate, in particolare per gli stadi avanzati ( 27 ). Un recente studio clinico sul cancro al pancreas metastatico ha dimostrato che FOLFOX-6 (oxaliplatino, leucovorina e 5-fluorouracile), aggiunto alla terapia standard di nab-paclitaxel più gemcitabina, ha aumentato la sopravvivenza globale mediana a 13,2 mesi rispetto ai 9,7 mesi con la terapia standard. Tuttavia, la tossicità del trattamento è stata maggiore con il nuovo regime ( 28 ). Pertanto, è fondamentale sviluppare nuove strategie terapeutiche che offrano maggiore efficacia e sicurezza, poiché la maggior parte dei trattamenti attuali è associata a significativi effetti avversi e risultati limitati a lungo termine.
Lo scopo del presente studio era dimostrare la sinergia della combinazione di rMETase e ivermectina sulle cellule tumorali pancreatiche umane, in vitro , come nuovo paradigma per il trattamento del cancro pancreatico.
Materiali e metodi
Coltura cellulare . Le cellule tumorali pancreatiche MiaPaCa-2 sono state ottenute dall’American Type Culture Collection (ATCC) (Manassas, VA, USA). Le cellule MiaPaCa-2 sono state coltivate in terreno di coltura di Eagle modificato di Dulbecco (DMEM) con l’aggiunta di siero bovino fetale (FBS) al 10% e 1 UI/ml di penicillina/streptomicina (10-013-CV; Corning, Corning, NY, USA).
Reagenti . L’ivermectina è stata ottenuta da MedChemExpress. (Monmouth Junction, NJ, USA). La metioninasi ricombinante (rMETase) è stata prodotta da AntiCancer Inc. come precedentemente descritto ( 29 ).
Saggio di sensibilità al farmaco 1: Determinazione dell’IC50 di ivermectina e rMETasi su cellule di cancro pancreatico MiaPaCa-2 in vitro . La vitalità cellulare è stata determinata con il reagente WST-8 (Dojindo Laboratory, Kumamoto, Giappone). Le cellule MiaPaCa-2 sono state coltivate in piastre da 96 pozzetti, con 3×103 cellule per pozzetto, in DMEM (100 μl per pozzetto). rMETasi (da 0,5 U/ml a 8 U/ml) o ivermectina (da 5 μM a 80 μM) sono state aggiunte alle cellule per 72 ore. Al termine del periodo di coltura, 10 μl della soluzione WST-8 sono stati aggiunti a ciascun pozzetto. Successivamente, la piastra è stata incubata per 1 ora a 37 °C. L’assorbimento è stato misurato a 450 nm con un lettore di micropiastre (SUNRISE: TECAN, Mannedorf, Svizzera) che indica l’entità delle cellule vitali. Microsoft Excel per Mac 2016 versione 15.52 (Microsoft, Redmond, WA, USA) è stato utilizzato per generare le curve di sensibilità al farmaco. ImageJ versione 1.53k (National Institutes of Health, Bethesda, MD, USA) è stato utilizzato per determinare i valori di concentrazione inibitoria semimassimale (IC50 ) . Ogni esperimento è stato condotto due volte in triplicato.
Saggio di sensibilità al farmaco 2: Determinazione della sinergia di ivermectina e rMETasi sulle cellule di cancro pancreatico MiaPaCa-2 . Le cellule MiaPaCa-2 sono state seminate in piastre da 96 pozzetti a una densità di 3×10 3 cellule per pozzetto. Le cellule sono state trattate come segue 24 ore dopo: Controllo (DMEM); sola ivermectina (5,9 μM [IC 50 ]); sola rMETasi (2,93 U/ml [IC 50 ]); ivermectina (5,9 μM [IC 50 ]) più rMETasi (2,93 U/ml [IC 50 ]). La vitalità delle cellule è stata valutata 72 ore dopo, come descritto sopra.
Analisi statistica . Per le analisi statistiche è stato utilizzato il software EZR (Jichi Medical University, Saitama, Giappone) ( 30 ). È stata utilizzata un’analisi Tukey-Kramer per analizzare la relazione tra le variabili e i valori p ≤0,05 sono stati considerati statisticamente significativi.
Risultati
IC50 di ivermectina da sola e rMETasi da sola su cellule di cancro pancreatico MiaPaCa-2 . Il valore di IC50 di ivermectina da sola su cellule MiaPaCa-2 era di 5,9 μM. L’IC50 di rMETasi da sola su cellule MiaPaCa-2 era di 2,93 U/ml ( Figura 1 ).
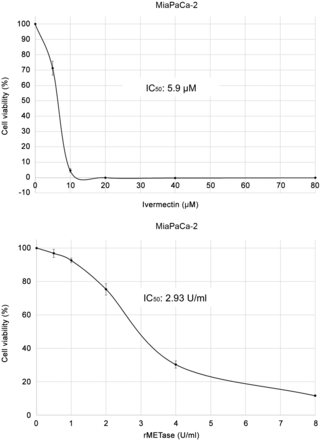
50 di ivermectina e metioninasi ricombinante (rMETasi) sulle cellule di cancro pancreatico MiaPaCa-2. (A)
IC 50 dell’ivermectina sulle cellule MiaPaCa-2. (B) IC
50 della rMETasi sulle cellule MiaPaCa-2.
Sinergia di rMETasi più ivermectina sulle cellule di cancro pancreatico MiaPaCa-2 . Rispetto alle cellule di controllo, il trattamento con sola ivermectina ha ridotto la vitalità delle cellule MiaPaCa-2 di circa il 54%, la sola rMETasi ha ridotto la vitalità delle cellule MiaPaCa-2 del 37% e la combinazione di ivermectina (5,9 μM [IC
50 ]) più rMETasi (2,93 U/ml [IC
50 ]) ha causato una riduzione significativamente maggiore della vitalità delle cellule MiaPaCa-2, circa l’80% rispetto alla sola ivermectina o alla sola rMETasi, p <0,05 ( Figura 2 ).
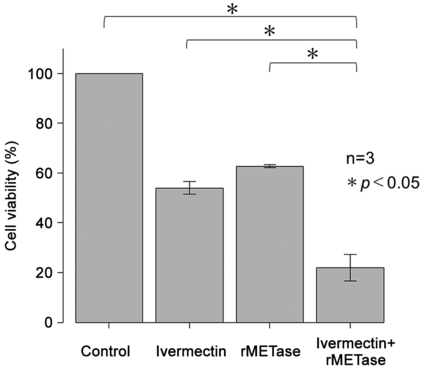
per cellule MiaPaCa-2]); rMETase (2,93 U/ml [IC50
per cellule MiaPaCa-2]); ivermectina (5,9 μM [IC50
per cellule MiaPaCa-2]) più rMETase (2,93 U/ml [IC50
per cellule MiaPaCa-2]).
Discussione
Il cancro al pancreas è la quarta causa più frequente di mortalità correlata al cancro a livello globale ed è uno dei tumori più recalcitranti. Il tasso di sopravvivenza a 5 anni è di circa il 10% a causa della diagnosi tardiva, delle metastasi ricorrenti e delle limitate alternative terapeutiche ( 31 – 34 ). Di conseguenza, è essenziale identificare nuovi agenti chemioterapici e progettare strategie terapeutiche efficaci.
L’ivermectina è un farmaco antiparassitario approvato dalla Food and Drug Administration (FDA) statunitense per uso umano ed è ampiamente utilizzato negli animali ( 35 ). L’ivermectina ha mostrato efficacia contro il cancro al seno, il cancro gastrointestinale, il cancro urologico, le neoplasie ematologiche, il cancro dell’apparato riproduttivo, il glioma, il cancro polmonare e il melanoma, nonché contro le cellule HeLa, in studi di laboratorio ( 36 ). L’ivermectina inverte la resistenza multifarmaco, sopprime l’angiogenesi e riduce la biogenesi mitocondriale ( 37 ).
La restrizione della metionina (MR) da parte della rMETasi induce le cellule tumorali ad entrare in un arresto reversibile nella fase tardiva S/G 2 del ciclo cellulare dove si verifica il danno al DNA ( 38 ). L’ivermectina induce l’arresto del ciclo in fase G 1 /S nelle cellule tumorali, che può anche causare danni al DNA ( 2 , 39 ). Nel presente studio, la combinazione di rMETasi e ivermectina ha mostrato un’efficacia sinergica contro le cellule tumorali pancreatiche MiaPaCa-2.
Il principale limite dello studio attuale è che è stato condotto in vitro , utilizzando una singola linea cellulare. Sebbene questa linea cellulare sia comunemente utilizzata nella ricerca sul cancro al pancreas, basarsi su un singolo modello limita la generalizzabilità dei nostri risultati, poiché i risultati potrebbero variare tra diverse linee cellulari tumorali. Inoltre, i meccanismi molecolari alla base dell’efficacia sinergica osservata non sono stati esplorati nel presente studio, lasciando irrisolti interrogativi sui percorsi e le interazioni specifici responsabili dell’efficacia del trattamento. Studi futuri dovrebbero includere una gamma più ampia di linee cellulari, indagare i meccanismi molecolari coinvolti e includere valutazioni di tossicità per fornire una valutazione più completa del potenziale terapeutico e della sicurezza dell’approccio attuale.
Tuttavia i risultati attuali dimostrano il potenziale terapeutico dell’ivermectina più rMETase, come trattamento combinato per i pazienti affetti da cancro al pancreas.
rMETase è efficace perché prende di mira il segno distintivo fondamentale del cancro, la dipendenza da metionina ( 4 , 38 , 40 – 66 ).
Ringraziamenti
Questo articolo è dedicato alla memoria di AR Moossa, MD, Sun Lee, MD, Professor Gordon H. Sato, Professor Li Jiaxi, Masaki Kitajima, MD, Joseph R. Bertino, MD, Shigeo Yagi, MDD, JAR Mead, Ph.D., Eugene P. Frenkel, MD, Professor Lev Bergelson, Professor Sheldon Penman, Professor John R. Raper, Joseph Leighton, MD e John Mendelsohn, MD.
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE…
Note a piè di pagina
- Contributi degli autoriSM, RMH e QH hanno progettato lo studio. QH ha fornito rMETase. SM ha eseguito gli esperimenti. SM ha contribuito in modo significativo alla stesura dell’articolo, che è stato poi revisionato da RMH. KM, BMK, MB, NY, KH, HK, SM, KI, TH, HT, QH e SD hanno letto criticamente il manoscritto.
- Conflitti di interessiGli autori hanno dichiarato che non vi sono conflitti di interesse in relazione a questo studio.
- Ricevuto il 13 ottobre 2024.
- Revisione ricevuta il 10 novembre 2024.
- Accettato il 15 novembre 2024.
- Copyright © 2025 International Institute of Anticancer Research (Dr. George J. Delinasios), Tutti i diritti riservati.
Questo articolo è un articolo open access distribuito secondo i termini e le condizioni della licenza internazionale Creative Commons Attribution (CC BY-NC-ND) 4.0 ( https://creativecommons.org/licenses/by-nc-nd/4.0 ).
Riferimenti
- ↵
- Campbell WC
- ↵
- Zhang P ,
- Zhang Y ,
- Liu K ,
- Liu B ,
- Xu W ,
- Gao J ,
- Ding L ,
- Tao L
- ↵
- Wang K ,
- Gao W ,
- Dou Q ,
- Chen H ,
- Li Q ,
- Bella CE ,
- Huang C
- ↵
- Hoffman RM ,
- Erbe RW
- ↵
- Morinaga S ,
- Han Q ,
- Mizuta K ,
- Kang BM ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Demura S ,
- Hoffman RM
- Choobin BB ,
- Kubota Y ,
- Han Q ,
- Ardjmand D ,
- Morinaga S ,
- Mizuta K ,
- Bouvet M. ,
- Tsunoda T ,
- Hoffman RM
- Morinaga S ,
- Han Q ,
- Kubota Y ,
- Mizuta K ,
- Kang BM ,
- Sato M ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Hoffman RM
- Ardjmand D ,
- Kubota Y ,
- Sato M ,
- Han Q ,
- Mizuta K ,
- Morinaga S ,
- Hoffman RM
- Kubota Y ,
- Han Q ,
- Morinaga S ,
- Tsunoda T ,
- Hoffman RM
- Sato M ,
- Han Q ,
- Kubota Y ,
- Baranov A ,
- Ardjmand D ,
- Mizuta K ,
- Morinaga S ,
- Kang BM ,
- Kobayashi N ,
- Bouvet M. ,
- Ichikawa Y ,
- Nakajima A ,
- Hoffman RM
- Kubota Y ,
- Aoki Y ,
- Masaki N ,
- Obara K ,
- Hamada K ,
- Han Q ,
- Bouvet M. ,
- Tsunoda T ,
- Hoffman RM
- ↵
- Morinaga S ,
- Han Q ,
- Kubota Y ,
- Mizuta K ,
- Kang BM ,
- Sato M ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Demura S ,
- Hoffman RM
- ↵
- Morinaga S ,
- Han Q ,
- Mizuta K ,
- Kang BM ,
- Sato M ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Demura S ,
- Hoffman RM
- Kubota Y ,
- Han Q ,
- Aoki Y ,
- Masaki N ,
- Obara K ,
- Hamada K ,
- Hozumi C. ,
- Wong ACW ,
- Bouvet M. ,
- Tsunoda T ,
- Hoffman RM
- ↵
- Morinaga S ,
- Han Q ,
- Mizuta K ,
- Kang BM ,
- Sato M ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Demura S ,
- Hoffman RM
- ↵
- Morinaga S ,
- Han Q ,
- Mizuta K ,
- Kang BM ,
- Sato M ,
- Bouvet M. ,
- Yamamoto N ,
- Hayashi K ,
- Kimura H ,
- Miwa S ,
- Igarashi K ,
- Higuchi T ,
- Tsuchiya H ,
- Demura S ,
- Hoffman RM
- Sato M ,
- Han Q ,
- Mori R ,
- Mizuta K ,
- Kang BM ,
- Morinaga S ,
- Kobayashi N ,
- Ichikawa Y ,
- Nakajima A ,
- Hoffman RM
- Kubota Y ,
- Sato T ,
- Hozumi C. ,
- Han Q ,
- Aoki Y ,
- Masaki N ,
- Obara K ,
- Tsunoda T ,
- Hoffman RM
- Kubota Y ,
- Han Q ,
- Masaki N ,
- Hozumi C. ,
- Hamada K ,
- Aoki Y ,
- Obara K ,
- Tsunoda T ,
- Hoffman RM
- Kubota Y ,
- Han Q ,
- Hamada K ,
- Aoki Y ,
- Masaki N ,
- Obara K ,
- Tsunoda T ,
- Hoffman RM
- Kubota Y ,
- Han Q ,
- Hozumi C. ,
- Masaki N ,
- Yamamoto J ,
- Aoki Y ,
- Tsunoda T ,
- Hoffman RM
- Han Q ,
- Tan Y ,
- Hoffman RM
- Sato M ,
- Han Q ,
- Mizuta K ,
- Mori R ,
- Kang BM ,
- Morinaga S ,
- Kobayashi N ,
- Ichikawa Y ,
- Nakajima A ,
- Hoffman RM
- ↵
- Sato M ,
- Han Q ,
- Hozumi C. ,
- Kujiraoka H ,
- Mizuta K ,
- Morinaga S ,
- Kang BM ,
- Kobayashi N ,
- Ichikawa Y ,
- Nakajima A ,
- Hoffman RM
- ↵
- Linehan A ,
- O’Reilly M ,
- McDermott R.
- O’Kane GM
- ↵
- Cutmore LC ,
- Brown NF ,
- Raj D ,
- Chauduri S ,
- Wang P ,
- Maher J ,
- Wang Y ,
- Lemoine NR ,
- Marshall JF
- ↵
- Siegel RL ,
- Miller KD ,
- Wagle NS ,
- Jemal A
- ↵
- Carrato A ,
- Pazo-Cid R ,
- Macarulla T ,
- Gallego J ,
- Jiménez-Fonseca P ,
- Rivera F ,
- Cano MT ,
- Rodriguez-Garrote M ,
- Pericay C ,
- Alés I ,
- Layos L ,
- Grana B ,
- Iranzo V ,
- Gallego I ,
- Garcia-Carbonero R ,
- di Mena IR ,
- Guillén-Ponce C ,
- Aranda E
- ↵
- Tan Y ,
- XuM ,
- Tan X ,
- Tan X ,
- Wang X ,
- Saikawa Y ,
- Nagahama T ,
- Sole X ,
- Lenz M ,
- Hoffman RM
- ↵
- Kanda Y
- ↵
- Jia Y ,
- Gu D ,
- Wan J ,
- Yu B ,
- Zhang X ,
- Chioreano EG ,
- Wang Y ,
- Xie J
- Hyatt HW ,
- Poteri SK
- Lee KH ,
- Chie EK ,
- Sono SA ,
- Kim JH ,
- Kwon J ,
- Han SW ,
- Oh DY ,
- Jang JY ,
- Kim JS ,
- Kim TY ,
- Bang YJ ,
- Kim SW ,
- Ha SW
- ↵
- Liang C ,
- Shi S ,
- Meng Q ,
- Liang D ,
- Ji S ,
- Zhang B ,
- Qin Y ,
- XuJ ,
- Ni Q ,
- Yu X
- ↵
- Zhang J ,
- Yan YJ ,
- Un J ,
- Huang SX ,
- Wang XJ ,
- XiangWS
- ↵
- Tang M ,
- Hu X ,
- Wang Y ,
- Yao X ,
- Zhang W ,
- YuC ,
- Cheng F ,
- Li J ,
- Fang Q
- ↵
- Juarez M ,
- Schcolnik-Cabrera A ,
- Dueñas-Gonzalez A
- ↵
- Hoffman RM ,
- Jacobsen SJ
- ↵
- Zhou S.
- Wu H ,
- Ning W ,
- Wu X ,
- XuX ,
- Maggio ,
- Li X ,
- Hu J ,
- Wang C ,
- Wang J
- ↵
- Wang Z ,
- Sì LY ,
- Lee JHJ ,
- Wu Z ,
- Mastica HY ,
- Chong PKW ,
- Teo CC ,
- Ang HY ,
- Peh KLE ,
- Yuan J ,
- Ma S ,
- Scegli LSK ,
- Basri N ,
- JiangX ,
- YuQ ,
- Hillmer AM ,
- Lim WT ,
- Lim TKH ,
- Takano A ,
- Tan EH ,
- Tan DSW ,
- Ciao YS ,
- Lim B ,
- Tam WL
- Kaiser P
- Coalson DW ,
- Mecham JO ,
- Stern PH ,
- Hoffman RM
- Stern PH ,
- Mecham JO ,
- Wallace CD ,
- Hoffman RM
- Stern PH ,
- Hoffman RM
- Aoki Y ,
- Han Q ,
- Tomo Y ,
- Yamamoto J ,
- Kubota Y ,
- Masaki N ,
- Obara K ,
- Hamada K ,
- Wang JD ,
- Inubushi S ,
- Bouvet M. ,
- Clarke SG ,
- Nishida K ,
- Hoffman RM
- Yamamoto J ,
- Inubushi S ,
- Han Q ,
- Tashiro Y ,
- Sugisawa N ,
- Hamada K ,
- Aoki Y ,
- Miyake K ,
- Matsuyama R.
- Bouvet M. ,
- Clarke SG ,
- Endo I ,
- Hoffman RM
- Aoki Y ,
- Tomo Y ,
- Han Q ,
- Yamamoto J ,
- Hamada K ,
- Masaki N ,
- Kubota Y ,
- Bouvet M. ,
- Nishida K ,
- Hoffman RM
- Aoki Y ,
- Tomo Y ,
- Han Q ,
- Yamamoto J ,
- Hamada K ,
- Masaki N ,
- Bouvet M. ,
- Nishida K ,
- Hoffman RM
- Aoki Y ,
- Yamamoto J ,
- Tomo Y ,
- Hamada K ,
- Masaki N ,
- Inubushi S ,
- Tashiro Y ,
- Bouvet M. ,
- Endo I ,
- Nishida K ,
- Hoffman RM
- Hoffman RM ,
- Jacobsen SJ ,
- Erbe RW
- Hoffman RM ,
- Jacobsen SJ ,
- Erbe RW
- Yamamoto J ,
- Aoki Y ,
- Han Q ,
- Sugisawa N ,
- Sole YU ,
- Hamada K ,
- Nishino H ,
- Inubushi S ,
- Miyake K ,
- Matsuyama R.
- Bouvet M. ,
- Endo I ,
- Hoffman RM
- Yamamoto J ,
- Han Q ,
- Inubushi S ,
- Sugisawa N ,
- Hamada K ,
- Nishino H ,
- Miyake K ,
- Kumamoto T ,
- Matsuyama R.
- Bouvet M. ,
- Endo I ,
- Hoffman RM
- Yano S ,
- Li S ,
- Han Q ,
- Tan Y ,
- Bouvet M. ,
- Fujiwara T ,
- Hoffman RM
- Abo Qoura L ,
- Balakin KV ,
- Hoffman RM ,
- Pokrovsky VS
- Hoffman RM
- Ghergurovich JM ,
- XuX ,
- Wang JZ ,
- Yang L ,
- Ryseck RP ,
- Wang L ,
- Rabinowitz JD
- Sullivan MR ,
- Darnell AM ,
- Reilly MF ,
- Kunchok T ,
- Joesch-Cohen L ,
- Rosenberg D. ,
- Ali A ,
- Rees MG ,
- Roth JA ,
- Lewis CA ,
- Vander Heiden MG
- Mecham JO ,
- Rowitch D ,
- Wallace C ,
- Stern PH ,
- Hoffman RM
- Tan Y ,
- XuM ,
- Hoffman RM
- Stern PH ,
- Wallace CD ,
- Hoffman RM
- Hoffman RM ,
- Coalson DW ,
- Jacobsen SJ ,
- Erbe RW
- Oden KL ,
- Carson K ,
- Mecham JO ,
- Hoffman RM ,
- Clarke S
- Rubnitz JE ,
- Jacobsen SJ ,
- Hoffman RM
- Hoffman RM
- ↵
- Jacobsen SJ ,
- Hoffman RM ,
- Erbe RW
LO STUDIO TRADOTTO IN ITALIANO BY LVOGRUPPO.COM