Un’indagine durata due anni condotta da The Lever ha scoperto che la FDA ha approvato centinaia di farmaci negli ultimi decenni con poche o nessuna evidenza che funzionino. L’indagine ha rilevato che molti dei farmaci approvati che non fornivano alcun beneficio sono stati autorizzati a rimanere sul mercato, nonostante le evidenze che causano gravi danni.
La Food and Drug Administration (FDA) degli Stati Uniti ha approvato centinaia di farmaci negli ultimi decenni con poche o nessuna evidenza che funzionino, secondo una nuova indagine condotta da The Lever.
Molti dei farmaci sono autorizzati a rimanere sul mercato, nonostante ampie evidenze che non funzionano e che causano danni gravi e irreparabili.
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE
L’indagine biennale di The Lever sui farmaci approvati dalla FDA ha analizzato rapporti governativi, documenti interni della FDA, note degli investigatori, testimonianze congressuali, atti giudiziari e più di 100 interviste con ricercatori, funzionari federali e pazienti.
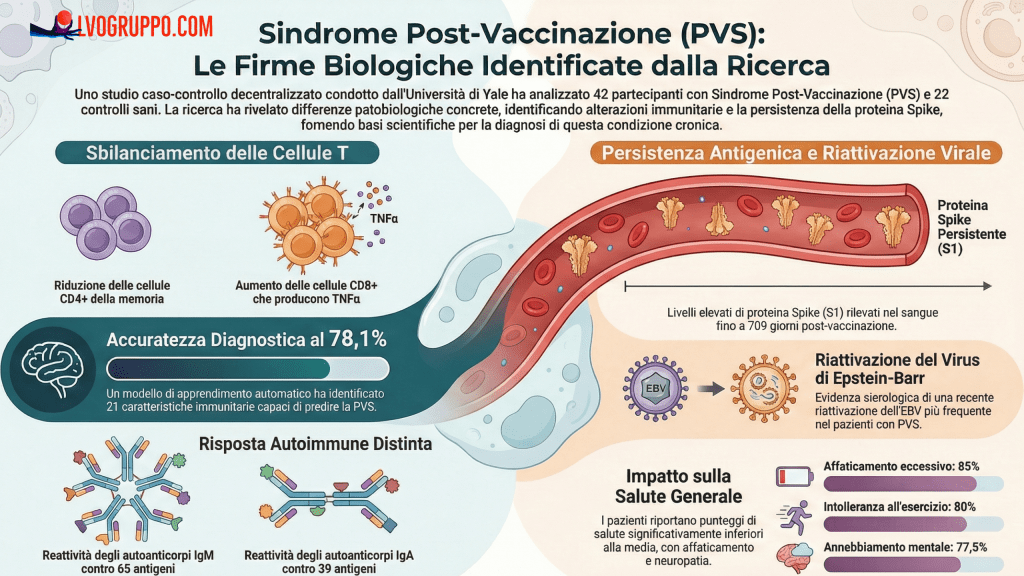
L’indagine ha scoperto che dal 2013 al 2022, il 73% dei farmaci approvati dalla FDA non soddisfaceva i quattro standard fondamentali dell’agenzia necessari per dimostrare che i farmaci funzionano come previsto. Cinquantacinque dei farmaci approvati soddisfacevano solo uno di questi quattro standard, e 39 non ne soddisfacevano nemmeno uno.
Più della metà delle approvazioni di farmaci si basava su dati preliminari, il che significava che le aziende farmaceutiche non presentavano evidenze che i pazienti avessero meno sintomi, mostrassero miglioramenti o avessero la vita prolungata.
Il tasso di approvazione di tali farmaci è accelerato nell’ultimo decennio, secondo l’Ufficio dell’Ispettore Generale del Dipartimento della Salute e dei Servizi Umani degli Stati Uniti.
I trattamenti contro il cancro, in particolare, hanno sollevato gravi bandiere rosse. Solo il 2,4% dei 123 farmaci per il cancro soddisfaceva tutti i criteri, e 29 non ne soddisfacevano nessuno. La FDA ha approvato l’81% dei farmaci per il cancro basandosi su dati preliminari.

Il rapporto non ha valutato alcun vaccino.
The Lever ha scritto:
“Queste statistiche arrivano dopo miliardi di dollari e anni di lobbying da parte dell’industria farmaceutica e dei gruppi di advocacy dei pazienti che hanno fatto pressione sul Congresso per allentare gli standard scientifici della FDA.
“Il cambiamento sismico risultante dal dimostrare che i farmaci funzionano prima di essere approvati al dimostrare che funzionano solo dopo l’approvazione — se mai — è stato silenziosamente realizzato con virtualmente nessuna consapevolezza da parte dei medici o del pubblico.
“Gli assicuratori e i contribuenti pagano effettivamente per la ricerca dopo che i farmaci arrivano sul mercato mentre le aziende farmaceutiche raccolgono i profitti. I pazienti servono come cavie ignare — con conseguenze molto reali.”
L’outlet ha anche riportato che si stima che 128.000 persone vengano uccise ogni anno dagli effetti collaterali dei farmaci da prescrizione prescritti come indicato.
La richiesta di farmaci durante l’epidemia di AIDS ha portato a standard ridotti
La FDA regola prodotti per un valore di 3,9 trilioni di dollari ogni anno, inclusi farmaci, cibo, integratori, tabacco e dispositivi medici, secondo The Lever.
Fino all’epidemia di AIDS negli anni ’80, l’agenzia aveva procedure normative più rigorose. Tuttavia, le richieste degli attivisti che cercavano un accesso più rapido ai nuovi farmaci nel contesto della crisi dell’AIDS, con il supporto dell’industria farmaceutica, hanno portato all’allentamento dei requisiti per alcuni farmaci.
Ad esempio, i requisiti che le aziende farmaceutiche presentassero più di uno studio clinico controllato randomizzato che dimostrasse l’efficacia di un farmaco significavano che la ricerca sui farmaci richiedeva tempo — l’intero processo di approvazione poteva richiedere fino a 12 anni.
Nel 1992, la FDA ha creato il “percorso accelerato”, consentendo alle aziende di presentare solo dati preliminari che mostrassero l’efficacia dei farmaci per l’AIDS. Le aziende erano tenute a presentare ulteriori evidenze di efficacia dopo che i farmaci erano sul mercato.
Le nuove regole hanno anche permesso alle aziende di ottenere l’approvazione senza mostrare risultati clinici — evidenze che un farmaco abbia influenzato positivamente la vita di un paziente. Invece, potevano testare per “risultati surrogati”, considerati “ragionevolmente probabili per predire” un beneficio clinico.
Ad esempio, invece di un farmaco per gli ictus che dimostri di fermare gli ictus, può mostrare un endpoint surrogato, come il controllo della pressione sanguigna. Il farmaco per l’AIDS AZT ha ottenuto l’approvazione su questa base — aumentava il numero di cellule T necessarie per combattere i virus, ma non aveva effetto sull’AIDS e invece si è dimostrato estremamente tossico per coloro che lo assumevano.
GSK, il produttore originale dell’AZT, ha raccolto 2 miliardi di dollari di profitti.
Nel 1992, il Congresso ha formalizzato gli standard ridotti nel Prescription Drug User Fee Act, che ha esplicitamente diretto la FDA a consentire approvazioni basate su standard più bassi.
I contributi farmaceutici alle campagne politiche sono aumentati drasticamente prima dell’approvazione del disegno di legge, da 1,9 milioni di dollari nel 1990 a 3,6 milioni di dollari nel 1992.
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE
La FDA approva farmaci basandosi su evidenze “fragili, contraddittorie e inadeguate”
The Lever ha identificato quattro criteri chiave che i produttori di farmaci dovrebbero soddisfare, secondo gli standard FDA, per valutare se i farmaci sono sicuri ed efficaci. Sono:
Gruppo di controllo: I pazienti che assumevano il farmaco erano confrontati con un gruppo di controllo che riceveva un placebo o un farmaco di confronto.
Replicazione: Almeno due studi “ben controllati” mostravano che il farmaco era efficace.
Cecità: I soggetti negli studi e i medici che li curavano non sapevano quali pazienti stavano assumendo il farmaco e quali erano nel gruppo di controllo.
Endpoint clinico: Gli studi misuravano l’effetto del farmaco sulla sopravvivenza o sulla funzione dei pazienti piuttosto che su una misura surrogata.
Gli autori notano che questi criteri non garantiscono “evidenze scientifiche solide”, ma costituiscono i criteri minimi per determinare se i produttori di farmaci hanno fornito “evidenze sostanziali” per supportare le loro affermazioni.
Solo il 28% dei farmaci approvati nei 10 anni studiati soddisfaceva i quattro criteri. Il 29% soddisfaceva tre criteri e più del 9% non ne soddisfaceva nessuno.
“Questo non significa che questi farmaci non funzionino, ma significa che la FDA li ha approvati senza sapere se è più probabile che aiutino i pazienti piuttosto che danneggiarli,” hanno scritto gli autori.

Più di un quarto dei farmaci era per il cancro, e uno su quattro di questi farmaci non soddisfaceva nessuno dei criteri. Questo perché le aziende ottengono comunemente l’approvazione di farmaci per il cancro basandosi su risultati surrogati, come la riduzione del tumore, piuttosto che su risultati clinici, come la riduzione della mortalità o la diminuzione dei sintomi.
“Gli esperti dicono che la FDA non dovrebbe avere illusioni riguardo all’inaffidabilità di tali risultati surrogati, specialmente dato che questi risultati non tengono conto dei danni che un farmaco può causare, come insufficienza epatica e anemia,” hanno scritto gli autori.
Un esempio notevole include l’approvazione accelerata dell’agenzia nel 2008 del farmaco Avastin per trattare il cancro al seno metastatico.
Prodotto da Genentech e commercializzato da Roche, Avastin ha incassato 6,8 miliardi di dollari entro il 2010. Alla fine, cinque studi clinici non sono riusciti a mostrare alcun miglioramento clinico per i pazienti che assumevano il farmaco. Invece, hanno mostrato che il farmaco causava coaguli di sangue, perforazione intestinale, ictus, problemi cardiaci e disfunzione renale.
La FDA alla fine ha ritirato la sua approvazione del farmaco nel novembre 2011, ma nel processo, l’agenzia e i pazienti sono stati attaccati e molestati dai produttori del farmaco. Da allora la FDA è stata riluttante a ritirare l’approvazione per i farmaci, secondo The Lever.
I produttori di farmaci che ottengono l’approvazione di farmaci oggi sul percorso accelerato dovrebbero condurre studi post-marketing per confermare la sicurezza e l’efficacia. Tuttavia, più di un terzo di questi farmaci approvati non ha mai avuto tale studio.
“La FDA continua ad approvare medicine basandosi su evidenze fragili, contraddittorie e inadeguate,” hanno scritto gli autori. “Citando la necessità di ‘flessibilità’ e l’importanza di incoraggiare lo sviluppo di farmaci quando ci sono poche opzioni di trattamento, l’agenzia ha praticamente abbandonato i suoi standard faticosamente conquistati per la scienza solida, secondo numerosi esperti.”
Che dire dei vaccini?
The Lever ha creato un database che i lettori possono consultare per determinare quanti dei quattro criteri soddisfano i farmaci approvati tra il 2013 e la fine del 2022.
L’elenco — e l’indagine — non include i vaccini.
Karl Jablonowski, Senior Research Scientist di Children’s Health Defense, ha detto che gli studi sui vaccini hanno una variabilità simile nel soddisfare i criteri delineati nell’indagine di The Lever.
Ha aggiunto che anche gli studi clinici che potrebbero affermare di soddisfare i criteri spesso lo fanno “solo di nome”.
Ad esempio, testare contro placebo che sono altri vaccini o che includono l’adiuvante contenuto nel vaccino non fornisce veri dati di sicurezza.

Ha detto:
“Un placebo specificamente non ha un effetto medico, tranne nella ricerca sui vaccini dove il ‘placebo’ può costituire tutti gli eccipienti [componenti aggiunti come conservanti o per aumentare l’efficacia] meno l’antigene. Gli eccipienti contengono le sostanze chimiche, o adiuvanti, che agitano il sistema immunitario e lo fanno prestare attenzione all’antigene.
“Più allarmante è l’adiuvante per il sistema immunitario, più è probabile che crei un’immunità duratura all’antigene co-somministrato. Ma gli adiuvanti sono sostanze chimiche davvero cattive, e non sono affatto una baseline salutare.”
Jablonowski ha anche detto che gli studi clinici non sono sempre in cieco, anche se affermano di esserlo. Ad esempio, lo studio Pfizer-BioNTech del vaccino COVID-19 mostra che il numero di pazienti che si sono ritirati dallo studio era del 45% maggiore nel gruppo placebo rispetto al gruppo vaccinato.
“Statisticamente, c’è una probabilità dello 0,02% che lo studio fosse effettivamente in cieco, o una probabilità del 99,98% che non fosse in cieco,” ha detto Jablonowski.
Molti vaccini testano per gli anticorpi, piuttosto che per la protezione contro la malattia. “Più una malattia è rara, più grande deve essere uno studio per catturare la significatività statistica,” secondo Jablonowski.
Altri vaccini, come il vaccino HPV Gardasil di Merck, che l’azienda pubblicizza come protezione delle donne contro il cancro cervicale, non sono mai stati testati clinicamente contro i risultati del cancro, perché tali tumori richiedono molto tempo per svilupparsi.
“Non esiste una cosa come uno studio clinico prospettico di 30 anni, quindi il vaccino HPV è stato approvato senza stabilire il risultato clinico primario,” ha detto.
Fonti e Riferimenti
U.S. Department of Health and Human Services Office of Inspector General report OEI-01-21-00401.pdf
Estimated 128,000 people killed by side effects
FDA regulates $3.9 trillion worth of products
Pharmaceutical industry support
Prescription Drug User Fee Act
Substantial evidence definition (21 CFR § 314.126)
Unreliability of such surrogate outcomes (BMJ)
Avastin to treat metastatic breast cancer (NEJM)
Five clinical trials on Avastin
FDA withdrew its approval of Avastin (Federal Register)
Flexibility in regulations (21 CFR § 314)
Pfizer-BioNTech study of the COVID-19 vaccine
Articoli Correlati
La FDA approva il vaccino mRNA RSV di Moderna — Senza input da consulenti indipendenti
Liberamente tradotto dall’articolo di Brenda Baletti, Ph.D.
5 giugno 2025 – Children’s Health Defense