Ci scusiamo coi lettori: la precedente versione del video aveva un problema di audio. qui sotto troverete la versione funzionante
Sono passati quattro anni dall’inizio della campagna di vaccinazione di massa contro il COVID-19 e in USA come in Europa i governi, non hanno fatto assolutamente nulla per affrontare i gravi rischi di morte cardiaca improvvisa tra l’80% della popolazione statunitense che ha ricevuto almeno una dose.
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE
Questo studio è anche il primo a chiarire in modo completo la sindrome nota come arresto cardiaco indotto dal vaccino COVID-19.
La mio-pericardite subclinica indotta da vaccini può scatenare tachicardia ventricolare da rientro o fibrillazione ventricolare spontanea, spesso precipitata da un picco di catecolamine durante l’esercizio fisico intenso o poco dopo il risveglio, portando alla morte cardiaca improvvisa.
È prudente per ogni medico di base avere un approccio prestabilito quando affronta questo problema nella propria pratica.
Vi RIPORTIAMO LO STUDIO TRADOTTO
Astratto
L’arresto cardiaco non annunciato tra giovani precedentemente sani senza malattia antecedente, mesi o anni dopo la vaccinazione contro la malattia da coronavirus 2019 (COVID-19), evidenzia l’urgente necessità di stratificare il rischio. La fisiopatologia sottostante più probabile è la miopericardite subclinica e latachicardia ventricolare da rientro o la fibrillazione ventricolare spontanea che è comunementeprecipitata dopo un picco di catecolamine durante l’esercizio fisico o le ore di veglia del sonno terminale. Piccole chiazze di infiammazione e/o edema possono essere perse all’imaging cardiaco e all’autopsia e il cuore può apparire grossolanamente normale. Questo articolo esamina le prove che collegano i vaccini COVID-19 all’arresto cardiaco, dove purtroppo la maggior parte delle vittime non ha avuto una valutazione clinica antecedente. Proponiamo una strategia completa per la valutazione del rischio cardiovascolare post-vaccinazione, che incorpora l’anamnesi dettagliata del paziente, i test anticorpali e la diagnostica cardiaca nel miglior tentativo di rilevare anomalie prima della morte cardiaca improvvisa. Questo approccio mira a identificare gli individui a più alto rischio di eventi cardiaci dopo la vaccinazione COVID-19 e a guidare un’appropriata gestione clinica. È prudente che ogni medico di base abbia un piano prestabilito quando affronta questo problema nella propria pratica.
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
Suggerimento principale: Questo studio esamina le prove che collegano i vaccini a mRNA alla patologia cardiaca e propone un approccio completo di stratificazione del rischio che coinvolge l’anamnesi del paziente, i test anticorpali e la diagnostica cardiaca. Identificando gli individui ad alto rischio attraverso endpoint misurabili come l’esposizione alla proteina spike e i biomarcatori cardiaci, questo approccio cerca di guidare i medici nell’affrontare i rischi di miocardite, aritmie e arresto cardiaco post-vaccinazione. L’implementazione di questo quadro nelle strutture di assistenza primaria può migliorare gli esiti cardiovascolari e ridurre le morti prevenibili.
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
Citazione: McCullough PA, Hulscher N. Stratificazione del rischio per futuro arresto cardiaco dopo la vaccinazione COVID-19. Mondo J Cardiol 2025; 17(2): 103909 URL: https://www.wjgnet.com/1949-8462/full/v17/i2/103909.htm DOI: https://dx.doi.org/10.4330/wjc.v17.i2.103909
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
GUARDA LA NOSTRA BIO E EFFETTUA UNA DONAZIONE
INTRODUZIONE
Continuiamo a osservare che le persone vaccinate contro la malattia da coronavirus 2019 (COVID-19) subiscono arresti cardiaci dall’inizio della campagna di vaccinazione di massa alla fine del 2020[1-5].
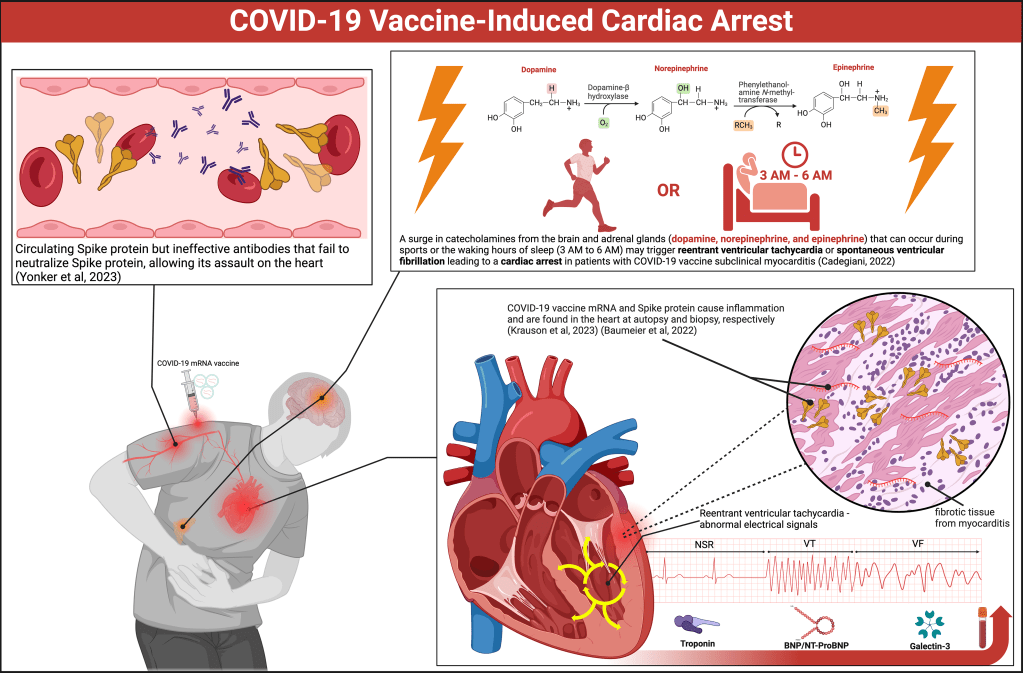
La Figura 1 illustra i probabili meccanismi. Sia l’mRNA di Pfizer-BioNTech (BNT162b2) che quello di Moderna (mRNA-1273) sono stati trovati nel muscolo cardiaco umano durante l’autopsia[6]. La proteina spike è stata colorata in campioni di biopsia endomiocardica di giovani uomini affetti da miocardite indotta da vaccino COVID-19[7].
È stato scoperto che le vittime hanno la proteina Spike circolante ma anticorpi inefficaci, probabilmente sottoclasse IgG4, che non riescono a neutralizzare la proteina Spike e a consentirne l’assalto al cuore[8]. I dati della tomografia a emissione di positroni hanno rivelato un passaggio dal metabolismo degli acidi grassi liberi al metabolismo del glucosio nel cuore della maggior parte degli individui che hanno ricevuto un vaccino COVID-19[9].
Il modello di tomografia a emissione di positroni assomiglia all’ischemia globale. Ciò potrebbe essere dovuto all’emo-agglutinazione della proteina Spike del vaccino nei capillari miocardici o a cambiamenti cellulari nella respirazione mitocondriale e nel metabolismo dei substrati[10].
Piccole chiazze di miocardio disfunzionale, infiammato o cicatrizzato sono sufficienti a fungere da nido per la tachicardia ventricolare rientrante che può degradare in fibrillazione ventricolare e portare all’arresto cardiaco[11].
Un aumento delle catecolamine (epinefrina, noradrenalina e dopamina) che può verificarsi durante lo sport o durante le ore di veglia del sonno (dalle 3 alle 6 del mattino) può innescare la tachicardia ventricolare da rientro o la fibrillazione ventricolare spontanea che porta a un arresto cardiaco nei pazienti con miocardite subclinica da vaccino COVID-19[12].
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
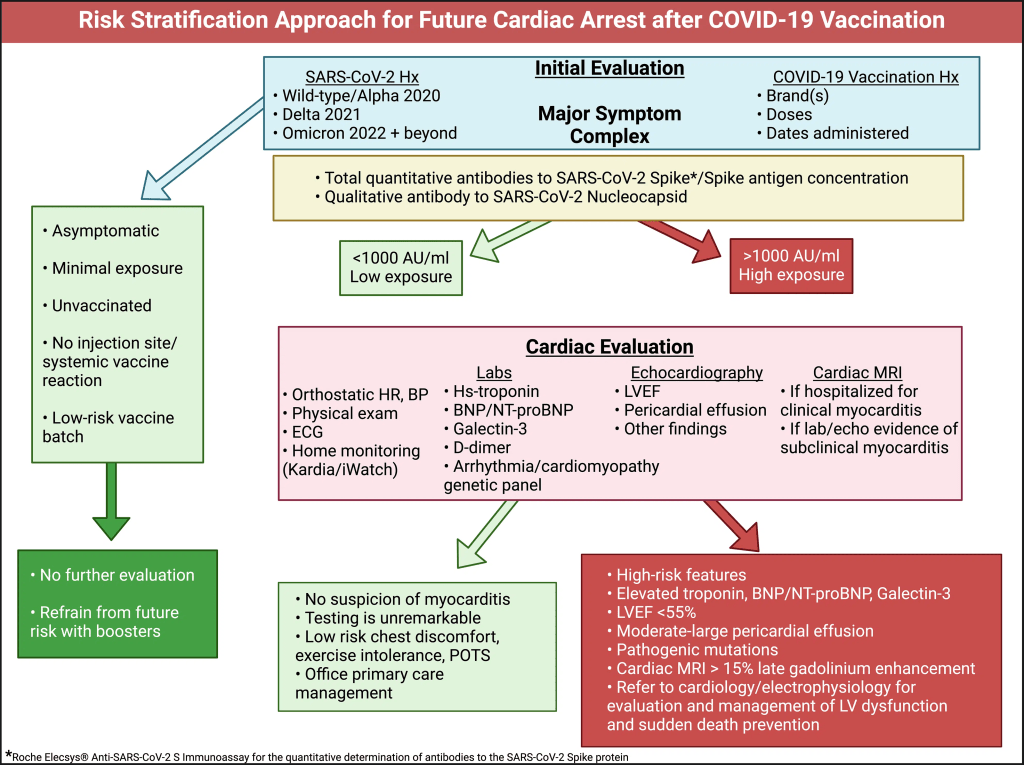
LOGICA DELLA STRATIFICAZIONE DEL RISCHIO L’elevato numero di morti improvvise tra gli atleti dopo la vaccinazione contro il COVID-19 ha sollevato preoccupazioni[13]. Alessandria et al[14] hanno amplificato queste preoccupazioni, dimostrando un rischio di morte per tutte le cause più elevato negli individui vaccinati con COVID-19 rispetto ai non vaccinati. I partecipanti che hanno ricevuto 2 dosi hanno perso il 37% dell’aspettativa di vita rispetto alla popolazione non vaccinatadurante il follow-up. Il più grande studio sulla sicurezza del vaccino COVID-19 condotto fino ad oggi, condotto su circa 99 milioni di individui vaccinati, ha rilevato che il rischio di miocardite era significativamente elevato dopo le vaccinazioni mRNA COVID-19, con un rischio superiore del 510% dopo la seconda dose del vaccino mRNA-1273 e del 186% dopo la seconda dose del vaccino BNT162b2, rispetto ai tassi basali[15]. Hulscher et al[16] hanno dimostrato che l’arresto cardiaco entro poche settimane dalla vaccinazione COVID-19 è probabilmente causato da miocardite da vaccino senza una precedente fase premonitore che ne consenta il rilevamento. Rose et al[17] hanno scoperto che tra gli individui con miocardite clinica poco dopo la vaccinazione COVID-19 segnalati al Vaccine Adverse Event Reporting System (VAERS), il tasso di mortalità era del 2,9%. Il Center for Biologics Evaluation and Research della Food and Drug Administration degli Stati Uniti ha stabilito un periodo di follow-up da 5 a 15 anni per i nuovi prodotti genetici per monitorare eventuali effetti avversi a lungo termine che potrebbero emergere nella popolazione esposta[18]. Con il passare del tempo, abbiamo imparato molto dalla valutazione di molte vittime danneggiate dal vaccino che hanno sintomi mesi o anni dopo l’iniezione[19-21]. Brogna et al[22] hanno trovato la proteina Spike di prefusione stabilizzata generata dal vaccino in soggetti fino a 6 mesi dopo la vaccinazione mRNA COVID-19. Leanomalie cardiache sono state osservate per almeno un anno dopo la diagnosi iniziale di miocardite indotta dal vaccino COVID-19, suggerendo il potenziale di effetti a lungo termine[23]. Al 13 gennaio 2025, non siamo a conoscenza di alcun approccio di stratificazione del rischio pubblicato per la prevenzione dell’arresto cardiaco indotto dal vaccino COVID-19. Pertanto, proponiamo una strategia globale per affrontare questa preoccupante lacuna nella conoscenza. APPROCCIO ALLA STRATIFICAZIONE DEL RISCHIO Quando i pazienti vengono visitati nella pratica clinica per la valutazione iniziale dei sintomi cardiovascolari a seguito di infezione da sindrome respiratoria acuta grave da coronavirus 2 (SARS-CoV-2) o vaccinazione, un approccio proposto è delineato nella Figura 2. La miocardite indotta dal vaccino COVID-19 è causata principalmente dalla proteina Spike[7,8,16,24]. Le misure dell’attivazione e dell’infiammazione delle citochine sono secondarie alla proteina Spike residente nel miocardio e circolante nel sangue [7,8].
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
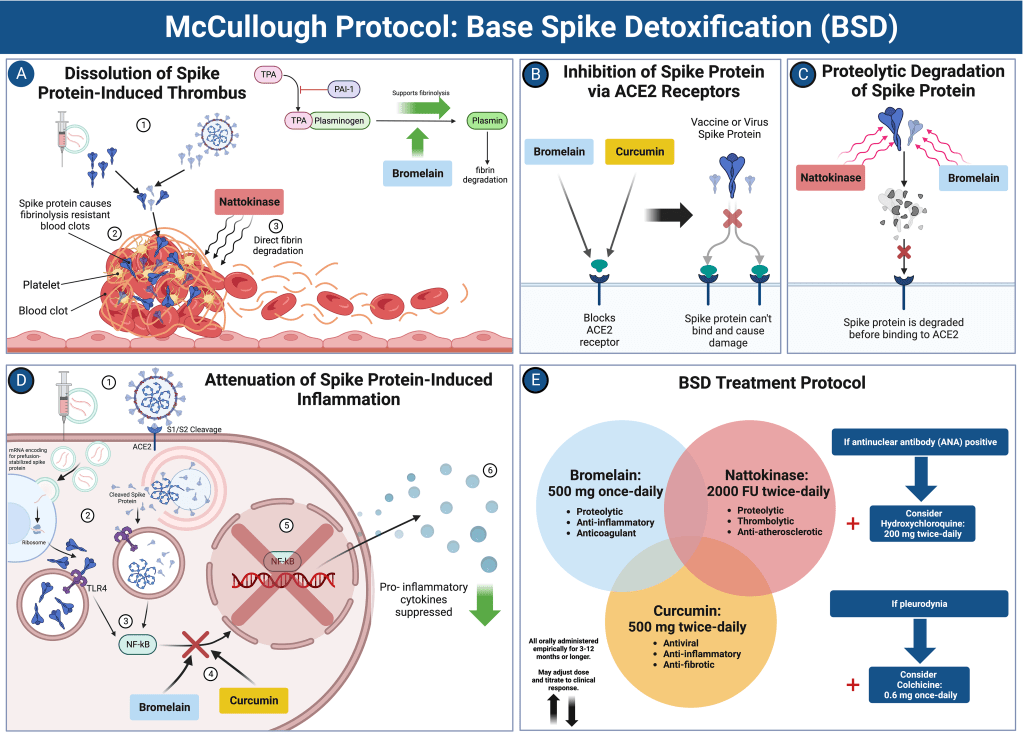
Un’anamnesi dettagliata dell’infezione da SARS-CoV-2 e della somministrazione del vaccino è essenziale per la valutazione. Va notato il COVID-19 grave che richiede il ricovero in ospedale e la ventilazione meccanica. Ogni infezione da SARS-CoV-2 e dose di vaccino COVID-19 può essere considerata una “esposizione”. Si può ragionevolmente presumere che maggiore è il numero di esposizioni, più è probabile che ci siano grandi quantità di proteina Spike nel corpo, dove le proteasi naturali e i lisosomi sembrano incapaci di eliminarla [25]. Un anticorpo totale a intervallo esteso contro la proteina Spike è un utile proxy per una precedente esposizione a Spike. Ad esempio, il test Anti-SARS-CoV-2 Spike di Roche Diagnostics Elecsys misura gli anticorpi contro il dominio di legame del recettore[26]. Il test Roche Elecsys Anti-SARS-CoV-2 ha un valore normale di < 0,8 U/mL e, nella pratica clinica, 0-1000 è a basso rischio e > 1000 indica un rischio più elevato con infezioni multiple o somministrazioni di vaccini COVID-19. Abbiamo osservato che non è raro trovare pazienti con > 25000 U/mL, che rimangono incommensurabilmente alti anche anni dopo la vaccinazione. Le concentrazioni di anticorpi possono richiedere almeno 12 mesi per diminuire. Pertanto, un test dell’antigene Spike misurabile nel sangue intero, nel plasma o nel siero è estremamente necessario per fornire una stima in tempo reale della tossicità dello Spike. Se (1) il numero di esposizioni alla proteina Spike era basso; (2) ci sono state infezioni non gravi; (3) I livelli di anticorpi spike sono inferiori a 1000 U/mL; (4) sito di iniezione minimo o assente o reazione sistemica iniziale alla vaccinazione[27,28]; e (5) se il vaccino è stato ottenuto da un lotto a basso rischio[29,30] (con zero ricoveri e decessi riscontrati in un’analisi del lotto VAERS[31]), allora potrebbero non essere necessarie ulteriori indagini cliniche. Se ci sono caratteristiche di rischio più elevate, come indicato nella Figura 2, è prudente eseguire test cardiaci più formali e stratificare il rischio. È ragionevole ottenere un elettrocardiogramma e un esame del sangue per troponina ad alta sensibilità, BNP/NT-ProBNP, galectina-3 e D-dimero. La troponina elevata può indicare una miocardite in corso[32]. BNP/NT-proBNP sono indicatori affidabili di pressione cardiaca/sovraccarico di volume e predicono l’insufficienza cardiaca [33]. La galectina-3 è un marcatore di infiammazione/fibrosi cronica e, quando elevata, predice l’insufficienza cardiaca futura[34]. Il D-dimero è un proxy per la microcoagulazione del sangue[35] e, nella nostra esperienza, < 0,2 è a basso rischio, 0,2-0,5 è moderato e > 0,5 è ad alto rischio di eventi trombotici. Patel et al[36] hanno dimostratoche il 17% dei partecipanti ha mostrato un aumento dei livelli di d-dimero rispetto al normale basale dopo la vaccinazione COVID-19. I test genetici per le mutazioni patogene nei canali ionici cardiaci o nelle proteine principali sono ragionevoli nei pazienti con reperti ad alto rischio o arresto cardiaco rianimato. Le mutazioni nel canale del sodio SCN5A sono state associate a un aumento del rischio di arresto cardiaco da vaccino COVID-19[37]. L’ecocardiografia point-of-care o l’ecografia cardiaca formale e il Doppler possono essere utilizzati per valutare la struttura cardiaca, la funzione e la presenza di liquido pericardico[38]. Questo pacchetto di diagnostica, quando i risultati sono completamente normali, suggerisce un basso rischio di futura insufficienza cardiaca e morte cardiaca[39]. Al contrario, molteplici anomalie riscontrate nell’elettrocardiogramma, negli esami del sangue e nell’ecocardiografia possono richiedere l’uso della risonanza magnetica cardiaca (MRI) con contrasto[40]. La risonanza magnetica è confermativa per la funzione ventricolare sinistra e, soprattutto, può rilevare aree di infiammazione/cicatrice con aumento tardivo del gadolinio (LGE)[41]. In altri tipi di cardiomiopatia, l’LGE ≥ il 15% del ventricolo sinistro indica un alto rischio di arresto cardiaco[42]. Piccole chiazze di infiammazione miocardica, edema o fibrosi potrebbero non essere rilevabili da fette assiali alla risonanza magnetica cardiaca o all’autopsia[43,44]. Pertanto, il cuore può apparire normale all’esame post-mortem e il rapporto finale può indicare la morte per “cause naturali” in un paziente sano senza malattia antecedente. Riteniamo che questi casi rappresentino probabilmente miocardite subclinica precedentemente silente e fibrosi cardiaca che funge da substrato per la tachicardia ventricolare rientrante che degenera in fibrillazione ventricolare e asistolia nei pazienti che non ricevono una defibrillazione immediata. Quando la stratificazione del rischio indica un basso rischio, la gestione dell’ufficio di assistenza primaria è suggerita con il Protocollo McCullough: Disintossicazione Base Spike e farmaci aggiuntivi a seconda della sindrome (Figura 3)[25]. Per la miopericardite subclinica, la colchicina orale 0,6 mg due volte al giorno (BID) o una volta al giorno è indicata per almeno un anno[45]. Per la sindrome da tachicardia posturale ortostatica indotta da vaccino COVID-19, può essere utile l’uso di colchicina e nadololo 20-40 mg BID[46]. Nei pazienti che risultano ad alto rischio, è indicata anche la disintossicazione da Base Spike[25]. Per coloro che sono ad alto rischio di cardiomiopatia e/o aritmie ventricolari, viene suggerita una consultazione cardiologica formale con l’obiettivo principale di prevenire l’insufficienza cardiaca e la morte improvvisa. Inoltre, alcuni pazienti possono richiedere l’impianto di ICD in presenza di aritmie sintomatiche, LGE > 15% o predittori genetici come mutazioni patogene SCN5A [37,47].
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
Sebbene questo quadro sia progettato per la popolazione generale, è importante riconoscere che sottogruppi specifici, come gli anziani e gli individui con condizioni cardiovascolari preesistenti, possono richiedere ulteriori considerazioni. Gli anziani, ad esempio, possono beneficiare di un monitoraggio più frequente e di strategie preventive su misura per mitigare i rischi più elevati associati ai cambiamenti cardiovascolari legati all’età. Allo stesso modo, i pazienti con una storia di malattie cardiache dovrebbero sottoporsi a valutazioni e interventi personalizzati per affrontare le loro vulnerabilità uniche. L’incorporazione di questi approcci specifici per sottogruppi migliorerà ulteriormente l’utilità pratica del quadro proposto in diverse popolazioni di pazienti. Sebbene il quadro di stratificazione del rischio proposto sia già supportato da prove indirette sostanziali e da solidi principi clinici, è importante notare che attualmente mancano dati sull’implementazione nel mondo reale. Ciò rappresenta un’opportunità per convalidarne l’efficacia attraverso future analisi retrospettive e studi clinici prospettici, che non solo ne rafforzeranno l’utilità, ma ne perfezioneranno anche l’applicazione pratica. Colmando questo divario, il quadro ha il potenziale per diventare uno strumento indispensabile per migliorare i risultati dei pazienti e guidare l’assistenza basata sull’evidenza. CONCLUSIONE In sintesi, abbiamo proposto un approccio di stratificazione del rischio che affronta la preoccupazione clinica di un futuro arresto cardiaco dopo la vaccinazione COVID-19. I numerosi studi che evidenziano gravi problemi di sicurezza cardiovascolare legati ai vaccini COVID-19 hanno sensibilizzato l’opinione pubblica e i medici. È prudente per ogni medico di base avere un approccio prestabilito quando affronta questo problema nella propria pratica. Note Provenienza e revisione paritaria: Articolo non richiesto; Revisione paritaria esterna. Modello di revisione tra pari: Tenda singola Tipo di specialità: Apparato cardiovascolare e cardiaco Paese di origine: Stati Uniti Classificazione del rapporto di peer-review Qualità scientifica: Grado C Novità: Grado B Creatività o innovazione: Grado B Significato scientifico: Grado B Revisore P: Qi W S-Editore: Lin C L-Editore: A P-Editore: Zhang XD
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]
Referenze 1. Hulscher N, Cook MJ, Stricker RB, McCullough PA. Arresto cardiopolmonare in eccesso e mortalità dopo la vaccinazione COVID-19 nella contea di King, Washington. J Emerg Med OA. 2024; 2:1-11. 2. Li YE, Wang S, Reiter RJ, Ren J. Emergenze cardiovascolari cliniche e basi cellulari della vaccinazione COVID-19: dal sogno alla realtà? Int J Infettare Dis. 2022; 124:1-10. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in RCA: 12] [Analisi delle citazioni di riferimento (3)] 3. Sun CLF, Jaffe E, Levi R. Aumento degli eventi cardiovascolari di emergenza tra la popolazione sotto i 40 anni in Israele durante il lancio del vaccino e la terza ondata di COVID-19. Sci Rep. 2022; 12:6978. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 17] [Citato da in RCA: 30] [Influenza dell’articolo: 10.0] [Analisi delle citazioni di riferimento (2)] 4. Sadiq W, Waleed MS, Suen P, Chalhoub MN. Arresto cardiopolmonare dopo la vaccinazione COVID-19: un caso clinico. Cureus. 2022; 14:e21141. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in RCA: 1] [Analisi delle citazioni di riferimento (4)] 5. Maruyama T, Uesako H. Lezioni apprese da una serie di casi di arresto cardiaco extraospedaliero e morte inaspettata dopo la vaccinazione COVID-19. Stagista Med. 2023; 62:3267-3275. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (1)] 6. Krauson AJ, Casimero FVC, Siddiquee Z, Stone JR. Durata della persistenza del vaccino mRNA SARS-CoV-2 e fattori associati al coinvolgimento cardiaco nei pazienti vaccinati di recente. Vaccini NPJ. 2023; 8:141. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 25] [Analisi delle citazioni di riferimento (0)] 7. Baumeier C, Aleshcheva G, Harms D, Gross U, Hamm C, Assmus B, Westenfeld R, Kelm M, Rammos S, Wenzel P, Münzel T, Elsässer A, Gailani M, Perings C, Bourakkadi A, Flesch M, Kempf T, Bauersachs J, Escher F, Schultheiss HP. Infiammazione intramiocardica dopo la vaccinazione COVID-19: una serie di casi comprovati da biopsia endomiocardica. Int J Mol Sci. 2022; 23. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 43] [Citato da in RCA: 42] [Influenza dell’articolo: 14.0] [Analisi della citazione di riferimento (0)] 8. Yonker LM, Swank Z, Bartsch YC, Burns MD, Kane A, Boribong BP, Davis JP, Loiselle M, Novak T, Senussi Y, Cheng CA, Burgess E, Edlow AG, Chou J, Dionne A, Balaguru D, Lahoud-Rahme M, Arditi M, Julg B, Randolph AG, Alter G, Fasano A, Walt DR. Proteina spike circolante rilevata nella miocardite da vaccino mRNA post-COVID-19. Diffusione. 2023; 147:867-876. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 64] [Citato da in RCA: 107] [Influenza dell’articolo: 53.5] [Analisi delle citazioni di riferimento (0)] 9. Nakahara T, Iwabuchi Y, Miyazawa R, Tonda K, Shiga T, Strauss HW, Antoniades C, Narula J, Jinzaki M. Valutazione della captazione miocardica (18)F-FDG alla PET/CT in pazienti asintomatici vaccinati con SARS-CoV-2 e non vaccinati. Radiologia. 2023; 308:e230743. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 16] [Citato da in RCA: 17] [Influenza dell’articolo: 8.5] [Analisi delle citazioni di riferimento (0)] 10. Scheim DE, Vottero P, Santin AD, Hirsh AG. I legami dei glicani sialilati della proteina spike SARS-CoV-2 alle cellule del sangue e dell’endotelio governano le gravi morbilità di COVID-19. Int J Mol Sci. 2023; 24. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 1] [Citato da in RCA: 10] [Influenza dell’articolo: 5.0] [Analisi delle citazioni di riferimento (0)] 11. Vähätalo JH, Huikuri HV, Holmström LTA, Kenttä TV, Haukilahti MAE, Pakanen L, Kaikkonen KS, Tikkanen J, Perkiömäki JS, Myerburg RJ, Junttila MJ. Associazione tra infarto miocardico silente e morte cardiaca improvvisa. JAMA Cardiol. 2019; 4:796-802. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 33] [Citato da in RCA: 48] [Influenza dell’articolo: 9.6] [Analisi delle citazioni di riferimento (0)] 12. Cadegiani FA. Le catecolamine sono il fattore scatenante principale della miocardite indotta da vaccino mRNA COVID-19: un’ipotesi convincente supportata da risultati epidemiologici, anatomopatologici, molecolari e fisiologici. Cureus. 2022; 14:e27883. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 6] [Citato da in RCA: 5] [Influenza dell’articolo: 1.7] [Analisi delle citazioni di riferimento (0)] 13. Polykretis P, McCullough PA. Per continuare la vaccinazione COVID-19 sono necessarie valutazioni razionali dei benefici per fascia di età. Scand J Immunol. 2023; 98:e13242. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 8] [Citato da in RCA: 9] [Influenza dell’articolo: 4.5] [Analisi delle citazioni di riferimento (3)] 14. Alessandria M, Malatesta GM, Berrino F, Donzelli A. Un’analisi critica dei decessi per tutte le cause durante la vaccinazione COVID-19 in una provincia italiana. Microrganismi. 2024; 12. [RCA] [PubMed] [DOI] [Testo completo] [Analisi della citazione di riferimento (3)] 15. Faksova K, Walsh D, Jiang Y, Griffin J, Phillips A, Gentile A, Kwong JC, Macartney K, Naus M, Grange Z, Escolano S, Sepulveda G, Shetty A, Pillsbury A, Sullivan C, Naveed Z, Janjua NZ, Giglio N, Perälä J, Nasreen S, Gidding H, Hovi P, Vo T, Cui F, Deng L, Cullen L, Artama M, Lu H, Clothier HJ, Batty K, Paynter J, Petousis-Harris H, Buttery J, Black S, Hviid A. Vaccini COVID-19 ed eventi avversi di particolare interesse: uno studio di coorte multinazionale Global Vaccine Data Network (GVDN) su 99 milioni di individui vaccinati. Vaccino. 2024; 42:2200-2211. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 2] [Citato da in RCA: 49] [Influenza dell’articolo: 49.0] [Analisi delle citazioni di riferimento (1)] 16. Hulscher N, Hodkinson R, Makis W, McCullough PA. Risultati dell’autopsia in caso di miocardite fatale indotta da vaccino COVID-19. ESC Cuore fallito. 2024;. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 16] [Citato da in RCA: 15] [Influenza dell’articolo: 15.0] [Analisi delle citazioni di riferimento (0)] 17. Rose J, Hulscher N, McCullough PA. Determinanti della miocardite indotta dal vaccino COVID-19. Ther Adv Drug Saf. 2024; 15:20420986241226566. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 6] [Citato da in RCA: 5] [Influenza dell’articolo: 5.0] [Analisi delle citazioni di riferimento (0)] 18. Eisenman D, Swindle S. Guida della Food and Drug Administration sulla progettazione di studi clinici per prodotti di terapia genica con potenziale di integrazione del genoma o editing del genoma e follow-up a lungo termine associato dei soggetti di ricerca. 2022; 27:201-209. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 2] [Riferimento Analisi delle citazioni (0)] 19. Krumholz HM, Wu Y, Sawano M, Shah R, Zhou T, Arun AS, Khosla P, Kaleem S, Vashist A, Bhattacharjee B, Ding Q, Lu Y, Caraballo C, Warner F, Huang C, Herrin J, Putrino D, Hertz D, Dressen B, Iwasaki A. Sindrome post-vaccinazione: un’analisi descrittiva dei sintomi riportati e delle esperienze dei pazienti dopo l’immunizzazione Covid-19. medRxiv. 2023;. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 2] [Citato da in RCA: 7] [Influenza dell’articolo: 3.5] [Analisi delle citazioni di riferimento (0)] 20. Shrestha Y, Venkataraman R. La prevalenza della sindrome da vaccinazione post-COVID-19 e la qualità della vita tra gli individui vaccinati contro il COVID-19. Vacunas. 2023; 25:7-18. [DOI] [Testo completo] 21. Said KB, Al-Otaibi A, Aljaloud L, Al-Anazi B, Alsolami A, Alreshidi FS; A nome del gruppo Ha’il Com Research Unit. La frequenza e i modelli della sindrome da vaccinazione post-COVID-19 rivelano segni inizialmente lievi e potenzialmente immunocitopenici principalmente nelle giovani donne saudite. Vaccini (Basilea). 2022; 10. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in RCA: 1] [Analisi delle citazioni di riferimento (1)] 22. Brogna C, Cristoni S, Marino G, Montano L, Viduto V, Fabrowski M, Lettieri G, Piscopo M. Rilevamento della proteina Spike ricombinante nel sangue di individui vaccinati contro SARS-CoV-2: possibili meccanismi molecolari. Proteomica Clin Appl. 2023; 17:e2300048. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 2] [Citato da in RCA: 16] [Influenza dell’articolo: 8.0] [Analisi delle citazioni di riferimento (0)] 23. Yu CK, Tsao S, Ng CW, Chua GT, Chan KL, Shi J, Chan YY, Ip P, Kwan MY, Cheung YF. Valutazione cardiovascolare fino a un anno dopo la miocardite associata al vaccino COVID-19. Diffusione. 2023; 148:436-439. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 4] [Analisi delle citazioni di riferimento (2)] 24. Parry PI, Lefringhausen A, Turni C, Neil CJ, Cosford R, Hudson NJ, Gillespie J. “Spikeopathy”: la proteina spike COVID-19 è patogena, sia dal virus che dall’mRNA del vaccino. Biomedicina. 2023; 11. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 1] [Citato da in RCA: 26] [Influenza dell’articolo: 13.0] [Analisi delle citazioni di riferimento (0)] 25. Hulscher N, Procter BC, Wynn C, McCullough PA. Approccio clinico alle sequele post-acute dopo l’infezione da COVID-19 e vaccinazione. Curao. 2023; 15:e49204. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 3] [Citato da in RCA: 1] [Influenza dell’articolo: 0.5] [Analisi delle citazioni di riferimento (1)] 26. Riester E, Findeisen P, Hegel JK, Kabesch M, Ambrosch A, Rank CM, Pessl F, Laengin T, Niederhauser C. Valutazione delle prestazioni del test immunologico Roche Elecsys Anti-SARS-CoV-2 S. J Metodi Virol. 2021; 297:114271. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 38] [Citato da in RCA: 77] [Influenza dell’articolo: 19.3] [Analisi delle citazioni di riferimento (0)] 27. Komici K, Verderosa S, D’Amico F, Guerra G. Effetti collaterali auto-riferiti a seguito della vaccinazione COVID-19 negli atleti: uno studio retrospettivo. Hum Vaccin Immunother. 2023; 19:2234788. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 3] [Citato da in RCA: 5] [Influenza dell’articolo: 2.5] [Analisi delle citazioni di riferimento (0)] 28. Schwab C, Domke LM, Hartmann L, Stenzinger A, Longerich T, Schirmacher P. Caratterizzazione istopatologica autoptica della miocardite dopo vaccinazione anti-SARS-CoV-2. Clin Res Cardiol. 2023; 112:431-440. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 49] [Citato da in RCA: 34] [Influenza dell’articolo: 17.0] [Analisi delle citazioni di riferimento (0)] 29. Schmeling M, Manniche V, Hansen PR. Sicurezza dipendente dal lotto del vaccino mRNA COVID-19 BNT162b2. Eur J Clin Invest. 2023; 53:e13998. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 6] [Citato da in RCA: 14] [Influenza dell’articolo: 7.0] [Analisi delle citazioni di riferimento (0)] 30. Fürst T, Šourek P, Krátká Z, Janošek J. Sicurezza dei vaccini COVID-19 in funzione del lotto nella Repubblica Ceca e confronto con i dati della Danimarca. Eur J Clin Invest. 2024; 54:e14271. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (0)] 31. Hulscher N, Mccullough PA. Emorragia polmonare fatale ritardata dopo la vaccinazione COVID-19: caso clinico, analisi dei lotti e lista di controllo per l’autopsia proposta. Prestampa 2024. [DOI] [Testo completo] 32. Manno EC, Amodio D, Cotugno N, Rossetti C, Giancotta C, Santilli V, Zangari P, Rotulo GA, Villani A, Giglioni E, Turchetta A, Cafiero G, Franceschini A, Chinali M, Porzio O, Secinaro A, Palma P. Livelli più elevati di troponina al momento del ricovero sono associati a lesioni persistenti della risonanza magnetica cardiaca nei bambini che sviluppano miocardite dopo la vaccinazione COVID-19 basata su mRNA. Pediatr Infect Dis J. 2023; 42:166-171. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 9] [Analisi delle citazioni di riferimento (0)] 33. Silver MA, Maisel A, Yancy CW, McCullough PA, Burnett JC Jr, Francis GS, Mehra MR, Peacock WF 4th, Fonarow G, Gibler WB, Morrow DA, Hollander J; Gruppo di consenso BNP. BNP Consensus Panel 2004: Un approccio clinico per il ruolo diagnostico, prognostico, di screening, di monitoraggio del trattamento e terapeutico dei peptidi natriuretici nelle malattie cardiovascolari. Il cuore congestionato fallisce. 2004; 10:1-30. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 222] [Citato da in RCA: 214] [Influenza dell’articolo: 10.2] [Analisi delle citazioni di riferimento (0)] 34. McCullough PA, Olobatoke A, Vanhecke TE. Galectina-3: un nuovo esame del sangue per la valutazione e la gestione dei pazienti con insufficienza cardiaca. Rev Cardiovasc Med. 2011; 12:200-210. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 59] [Citato da in RCA: 84] [Influenza dell’articolo: 6.5] [Analisi delle citazioni di riferimento (0)] 35. Kell DB, Laubscher GJ, Pretorius E. Un ruolo centrale per i microcoaguli di fibrina amiloide nel long COVID/PASC: origini e implicazioni terapeutiche. Biochimica J. 2022; 479:537-559. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 104] [Citato da in RCA: 138] [Influenza dell’articolo: 46.0] [Analisi delle citazioni di riferimento (0)] 36. Patel F, Le Roux J, Sawry S, Kieser R, Dhar M, Gill K, Lazarus E, Nana A, Garrett N, Moore PL, Sigal A, Gray G, Rees HV, Jacobson BF, Fairlie L. Clot Twist – Analisi del D-dimero di adulti sani che ricevono un vaccino COVID-19 di richiamo eterologo o omologo dopo una singola dose primaria di Ad26.COV2.S in uno studio randomizzato di fase II in aperto, BaSiS. 2024 Preprint. [DOI] [Testo completo] 37. Ittiwut C, Mahasirimongkol S, Srisont S, Ittiwut R, Chockjamsai M, Durongkadech P, Sawaengdee W, Khunphon A, Larpadisorn K, Wattanapokayakit S, Wetchaphanphesat S, Arunotong S, Srimahachota S, Pittayawonganon C, Thammawijaya P, Sutdan D, Doungngern P, Khongphatthanayothin A, Kerr SJ, Shotelersuk V. Basi genetiche della morte improvvisa dopo la vaccinazione COVID-19 in Thailandia. Ritmo cardiaco. 2022; 19:1874-1879. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Citato da in Crossref: 14] [Citato da in RCA: 8] [Influenza dell’articolo: 2.7] [Analisi della citazione di riferimento (0)] 38. Maheshwari S, Dagor H. Evoluzione dell’ambito dell’ecografia cardiaca point-of-care nell’era attuale. Cura. 2024; 16:e53985. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (0)] 39. Money DB, Mehio M, Scoma C, Gupta S. Ecografia cardiaca point-of-care (POUS) Utilizzo per gli ospedalieri nella valutazione dei pazienti con disturbi cardiaci: una panoramica educativa. J Community Hosp Stagista Med Perspect. 2023; 13:1-8. [RCA] [PubMed] [DOI] [Testo completo] [Testo completo (PDF)] [Analisi delle citazioni di riferimento (0)] 40. Rajiah PS, François CJ, Leiner T. Risonanza magnetica cardiaca: stato dell’arte. Radiologia. 2023; 307:e223008. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 59] [Riferimento Citazione Analisi (0)] 41. Sen G, Scully P, Gordon P, Sado D. Progressi nella diagnosi della miocardite nelle miopatie infiammatorie idiopatiche: una panoramica dei test diagnostici. Reumatologia (Oxford). 2024; 63:1825-1836. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (0)] 42. Chan RH, Maron BJ, Olivotto I, Pencina MJ, Assenza GE, Haas T, Lesser JR, Gruner C, Crean AM, Rakowski H, Udelson JE, Rowin E, Lombardi M, Cecchi F, Tomberli B, Spirito P, Formisano F, Biagini E, Rapezzi C, De Cecco CN, Autore C, Cook EF, Hong SN, Gibson CM, Manning WJ, Appelbaum E, Maron MS. Valore prognostico della risonanza magnetica cardiovascolare quantitativa con mezzo di contrasto per la valutazione del rischio di morte improvvisa in pazienti con cardiomiopatia ipertrofica. Diffusione. 2014; 130:484-495. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in Crossref: 592] [Citato da in RCA: 745] [Influenza dell’articolo: 67.7] [Analisi delle citazioni di riferimento (0)] 43. Karur GR, Aneja A, Stojanovska J, Hanneman K, Latchamsetty R, Kersting D, Rajiah PS. Imaging of Cardiac Fibrosis: An Update, From the AJR Special Series on Imaging of Fibrosis. AJR Am J Roentgenol. 2024;222:e2329870. [RCA] [PubMed] [DOI] [Full Text] [Cited by in Crossref: 1] [Cited by in RCA: 1] [Article Influence: 1.0] [Reference Citation Analysis (0)] 44. Zhu L, Wang Y, Zhao S, Lu M. Detection of myocardial fibrosis: Where we stand. Front Cardiovasc Med. 2022;9:926378. [RCA] [PubMed] [DOI] [Full Text] [Full Text (PDF)] [Cited by in RCA: 22] [Reference Citation Analysis (0)] 45. Valore L, Junker T, Heilmann E, Zuern CS, Streif M, Drexler B, Arranto C, Halter JP, Berger CT. Caso clinico: miopericardite associata al vaccino COVID-19 mRNA-1273: trattamento di successo e riesposizione con colchicina. Cardiovasc Anteriore Med. 2023; 10:1135848. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (1)] 46. Sanada Y, Azuma J, Hirano Y, Hasegawa Y, Yamamoto T. Miocardite sovrapposta e sindrome da tachicardia posturale ortostatica dopo la vaccinazione con RNA messaggero COVID-19: un caso clinico. Cureus. 2022; 14:e31006. [RCA] [PubMed] [DOI] [Testo completo] [Analisi delle citazioni di riferimento (1)] 47. Tran HH, Sherpa ML, Shrestha N, Ravi N, Choday S, Shantha Kumar V, Kc A, Parisapogu A, Ojinna BT, Mohammed L. Sicurezza ed efficacia di un defibrillatore cardioverter impiantabile (ICD) nel rilevamento e nella prevenzione dell’aritmia cardiaca – Una revisione sistematica. Curao. 2023; 15:e48471. [RCA] [PubMed] [DOI] [Testo completo] [Citato da in RCA: 1] [Riferimento Analisi delle citazioni (0)]
McCullough PA, Hulscher N. Risk stratification for future cardiac arrest after COVID-19 vaccination. World J Cardiol 2025; 17(2): 103909 [PMID: 40061285 DOI: 10.4330/wjc.v17.i2.103909]